Détails de l’objectif du premier appel à projets du Programme prioritaire de recherche Antibiorésistance
Quels étaient les objectifs de ce premier appel à projets du PPR ?
L’hygiène, la prévention et la surveillance, ont contribué dans plusieurs pays à réduire la résistance aux antibiotiques. Cependant, il semble que ces mesures à elles seules ne peuvent endiguer complètement la résistance aux antimicrobiens dans sa globalité. D’autres alternatives doivent être soutenues pour contrôler et faire reculer l’antibiorésistance. Que ce soit en santé humaine, animale et environnementale, il y a un besoin de recherches pour acquérir de nouvelles connaissances et pour comprendre les mécanismes de l’hôte, du pathogène et des traitements qui contribuent à l’émergence de la résistance bactérienne, sa transmission et sa dissémination dans tous les écosystèmes. Le front des connaissances devrait permettre d’appréhender l’ensemble des mécanismes sous-jacents qui font, par exemple, qu’une infection bactérienne résiste à des traitements antibiotiques et d’élucider pourquoi certains patients, à haut risque d’infection durant leur hospitalisation, ne s’infectent pas.
En résumé, nous devons investiguer l’ensemble des mécanismes de l’hôte y compris, statut immunitaire, génétique, nutritionnel, psychologique, qui rend l’hôte robuste ou vulnérable à une infection bactérienne pour proposer un traitement thérapeutique plus efficace et éviter toute pression sélective. Côté bactérie, les enjeux sont de comprendre l’ensemble des mécanismes d’échappement aux traitements et aux alternatives en cours. Il est important de connaître la biologie des bactéries pour trouver de nouvelles cibles thérapeutiques, de comprendre comment les bactéries multi-résistantes émergent, résistent à leur environnement, se multiplient et persistent via des réservoirs et se disséminent dans différents hôtes et l’environnement.
L’effort de soutien à la recherche doit inclure le développement de nouvelles molécules, sans créer de résistance, pour éviter l’impasse thérapeutique, ainsi que de nouveaux outils de détection et de tests diagnostiques précoces pour enrayer, le plus tôt possible, la colonisation bactérienne à l’échelle de l’hôte, au niveau population (humaines et animales) pour retarder de possibles épidémies, et contrôler les réservoirs environnementaux. Ceci permettra de suivre avec pertinence, l’évolution globale de la résistance via des indicateurs normalisés, partagés et exploitables (notamment en tirant parti des dernières avancées technologiques telles que l’intelligence artificielle) dans tous les écosystèmes. Il est également crucial de développer une activité de recherche en sciences humaines et sociales, en épidémiologie et pour des études interventionnelles, afin de décrire, analyser et comprendre la perception du risque de l’antibiorésistance, et accroître la sensibilisation de l’ensemble des professionnels de santé et des usagers à un usage responsable des antibiotiques.
Ces différents champs d’investigation à la fois fondamentaux, cliniques, d’innovations et sociétaux doivent être soutenus au coeur d’un même programme de recherche qui doit aussi s’intéresser aux défis posés par l’antibiorésistance dans les pays aux ressources limitées compte tenu de l’impact de la mondialisation sur cette thématique. Un programme interdisciplinaire regroupant des communautés de scientifiques de différents horizons dont certaines n’ont pas encore inscrit dans leurs axes prioritaires l’antibiorésistance, serait un vrai levier permettant de croiser compétences et expertises pour ouvrir des voies de recherche non explorées et répondre aux besoins d’innovations, d’alternatives et de ruptures technologiques et comportementales.
L’interconnexion de disciplines travaillant autour d’un programme commun serait un atout pour dynamiser les recherches sur l’antibiorésistance, pour soutenir une recherche audacieuse aux risques maîtrisés, pour élargir les champs d’investigation actuels de la recherche académique et trouver des opportunités pour assurer des financements permettant de poursuivre les recherches amorcées.
Les 4 axes du PPR Antibiorésistance
Le programme prioritaire de recherche sur l’Antibiorésistance repose sur quatre piliers interdisciplinaires et interconnectés :
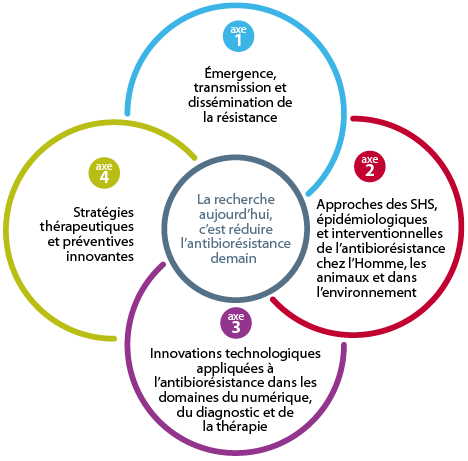
Pour chaque axe est décrit le contexte, les enjeux, les priorités de recherche et un plan d’actions, regroupant 18 objectifs, 53 actions et leurs indicateurs. Pris dans tout son ensemble, la problématique de la résistance aux antimicrobiens imposerait un programme d’actions plus dense en nombre d’objectifs et en complexité. Il a semblé plus pertinent au comité d’experts de ne se focaliser que sur la résistance aux antibiotiques. De manière à ce que le PPR reste ouvert et permette de prendre en compte des nouveaux enjeux de recherche et de santé publique sur les 10 ans à venir, le Comité scientifique, l’Inserm et ses partenaires, recommandent que dans sa globalité, le programme présenté en 2019 puisse évoluer et contribuer à soutenir des défis qui ne sont pas encore identifiés, et ceci en fonction du succès ou non des challenges qui seront engagés.
Axe 1 • Émergence, transmission et dissémination de la résistance
Contexte
Les antibiotiques sont le plus souvent des dérivés de composés naturels présents dans l’environnement, ayant leur propre métabolisme. La résistance aux antibiotiques est aussi un processus naturel qui a précédé leur usage par l’humain. L’usage d’antibiotiques, d’antiseptiques et désinfectants sur une espèce bactérienne entraîne la sélection de mutants résistants qui auront la capacité de se multiplier en présence de ces agents anti-infectieux. Le phénomène de sélection de variants résistants aux agents anti-infectieux suivant une exposition existe en microbiologie pour tous les organismes, que ce soit chez des bactéries, virus, champignons ou parasites. Cela s’observe également pour les agents cytotoxiques utilisés en chimiothérapie ou les insecticides dans la lutte anti-vectorielle. Certains concepts de sélection progressive de variants échappant au traitement et leur dissémination sont communs à ces processus. Néanmoins, la sélection et la transmission de la résistance des bactéries aux antibiotiques présentent deux particularités rendant leur dynamique particulièrement complexe. Tout d’abord, ces traitements vont aussi affecter les microbiotes de l’humain et des animaux ainsi que les communautés microbiennes de l’environnement, en modifiant leur composition et en sélectionnant des souches résistantes qui pourront ensuite disséminer vers d’autres réservoirs. Par ailleurs, une composante importante de la résistance résulte de l’acquisition de gènes de résistance (ARG) codant des pompes d’efflux ou des enzymes qui, par exemple, inactivent un antibiotique, ou modifient sa cible. Ces gènes de résistance sont fréquemment portés par des éléments génétiques mobiles (EGM) plasmidiques ou intégratifs, qui ont la capacité de passer d’une bactérie à l’autre au sein d’une même espèce ou entre espèces même éloignées phylogénétiquement. La sélection (l’émergence), la transmission et la dissémination de la résistance aux antibiotiques impliquent donc non seulement la circulation des souches, mais aussi celle des EGM dans des réservoirs multiples que constituent les populations humaines, animales et environnementales sous des pressions évolutives multiples.
Enjeux
La résistance aux antibiotiques représente un enjeu majeur de santé publique humaine et animale. Des réseaux de surveillance existent à des niveaux multiples : national avec pour la santé humaine Santé publique France via les CNR, l’ONERBA et les missions nationales des CPIAS, et l’ANSES pour la santé animale et l’environnement ; international avec l’OMS, l’OIE ou l’ECDC notamment ; mais aussi au niveau local à l’échelle d’un établissement de santé. La consommation des antibiotiques chez l’humain et l’animal ou leur relargage dans l’environnement sont également suivis. À côté de ces activités de surveillance essentielles pour repérer les modifications épidémiologiques dans le temps et l’espace, la compréhension des mécanismes de sélection, de transmission et de dissémination de la résistance doit combiner plusieurs approches : i) une approche évolutive sur la dynamique de sélection de souches résistantes aux traitements capables de disséminer (donc à faible coût biologique), ii) une approche moléculaire pour comprendre les mécanismes d’acquisition et de transfert des gènes de résistance et de mutations et iii) une approche écologique pour comprendre et modéliser les interactions spatiales entre microbiotes et les pressions de sélection intermittentes auxquelles sont soumises les bactéries.
Un enjeu pour l’avenir est d’intégrer dans ces études des approches innovantes pour la compréhension fine des processus mis en jeu (voir aussi axe 3) : approches « omiques » (génomique, métagénomique, transcriptomique, protéomique, et également métabolomique), les études en « single cell » ou en « single molecule », les nouvelles méthodes d’imagerie et des approches mathématiques et informatiques, notamment d’apprentissage.
Un second enjeu sera de combiner au moyen d’outils mathématiques les données de surveillance et les connaissances mécanistiques afin de modéliser les processus intervenant dans la sélection et la dissémination des souches résistantes aux antibiotiques et des gènes de résistance chez l’humain et l’animal ainsi que dans l’environnement. Ces modèles permettront d’évaluer, et prédire, le niveau de risque d’acquisition et de transmission de la résistance aux antibiotiques, associé à des politiques d’utilisation des antibiotiques, au niveau local ou national, des mesures de prévention liées aux soins, des procédures en élevage et de traitement des eaux.
Priorités de recherche
La sélection des gènes de résistance, des souches résistantes, des mécanismes de résistance
L’émergence d’un clone résistant est un processus complexe qui combine quatre composantes qui doivent être étudiées conjointement :
- Les gènes et mécanismes de résistance : la première étape dans la sélection d’un nouveau mécanisme de résistance est la capture de gènes de résistance dans des réservoirs environnementaux souvent peu explorés. Paradoxalement, l’origine environnementale de gènes de résistance majeurs circulants est encore inconnue. Les gènes de résistance après leur capture auront un potentiel variable à évoluer pour cibler de nouveaux antibiotiques.
- Les mutations chromosomiques : la sélection de souches résistantes procède également par l’acquisition de mutations (SNP, indels, recombinaison, amplification) dans divers systèmes intervenant directement ou indirectement dans le mode d’action d’un antibiotique ou dans son accumulation dans la bactérie.
- Les phénomènes de persistance, de tolérance et de dormance doivent être pris en compte dans l’émergence et la sélection des clones résistants. Ces phénomènes sont sous le contrôle de déterminants génétiques encore largement inconnus et sont des étapes préliminaires à l’acquisition de mutations conférant la résistance.
- La sélection et l’amplification d’une souche résistante dépendra de la pression de sélection par les antibiotiques et par de nombreuses autres molécules et/ou pratiques non-médicamenteuses ayant un effet synergique. Cette pression de sélection collatérale est le plus souvent mal connue, notamment pour les populations bactériennes qui ne sont pas directement ciblées par le traitement (espèces colonisant les microbiotes) ou dans l’environnement.
En conséquence, il est nécessaire d’aller au-delà du catalogue de ces gènes et mutations, mais aussi d’intégrer les observations dans un modèle complexe pour reconstruire la dynamique d’apparition des clones résistants et les mécanismes moléculaires sous-jacents en termes de sélection de mutation, de capture et de transfert de gènes de résistance et d’identifier les contraintes intervenant dans le succès d’un clone résistant comme la compatibilité des gènes de résistance ou EGM acquis avec un fond génétique et dans l’acquisition successive de gènes, de plasmides et de mutations de résistance.
Dissémination et transferts des clones et des gènes – les réservoirs
L’épidémiologie moléculaire décrit, pour différentes espèces de bactéries pathogènes, l’existence de clones dominants résistants à des antibiotiques et de gènes de résistance associés à des EGM, ainsi que leur distribution dans les différents réservoirs humains, animaux et environnementaux. La taille des populations de ces clones peut varier dans le temps et dans l’espace à l’échelle locale, nationale ou internationale. Les raisons du « succès » de ces clones sont encore largement inconnues, tout comme celles de leur disparition. Le séquençage génomique et une concertation internationale à mettre en œuvre doivent permettre d’identifier ces clones pour les espèces pathogènes majeures, leur circulation et leur distribution géographique dans une dimension « Une seule santé ».
Les propriétés de ces clones et les déterminants génétiques impliqués dans leur capacité à disséminer et à se transmettre entre réservoirs sont très divers. Ils incluent la capacité de colonisation et de persistance chez l’humain et l’animal ou dans l’environnement, la résistance aux stress, les interactions avec le microbiote de l’hôte, et pour les EGM porteurs de gènes de résistance leur capacité de transferts intra et inter-espèces. L’acquisition de la résistance a le plus souvent un coût biologique et la capacité à disséminer suppose de réduire ce coût.
Les clones épidémiques sélectionnés par ces processus peuvent avoir des propriétés de virulence particulières (hyper ou hypo-virulence) qui affectent le risque associé à ces clones et doivent être mieux comprises pour être prises en compte dans le diagnostic et la surveillance. Les clones résistants sont soumis de manière intermittente à une pression de sélection par des antibiotiques ou des antiseptiques, souvent à des doses faibles (sub-inhibitrices). Ils sont également soumis aux défenses de l’hôte (immunité innée, immunité acquise et vaccins) et à la résilience de l’environnement. C’est la résultante de ces contraintes évolutives et écologiques et la capacité d’adaptation d’un clone qui déterminent la dynamique des populations bactériennes résistantes.
Objectifs et plan d’actions
Objectif 1 • Établir une cartographie de la biodiversité des résistances aux antibiotiques dans les trois secteurs Humain-Animal-Environnement (HAE) et caractériser les voies de transmission intra- et inter-secteurs ainsi que les facteurs bactériens et environnementaux impliqués dans la transmission.
Action 1 : Nous mettrons en place des sites d’étude hospitaliers, en communautaire, en santé animale et dans l’environnement (en se basant notamment sur les sites ateliers existants) permettant de développer différents programmes de recherche dans des environnements suivis dans le temps et dans l’espace. Ces études pourront inclure des modèles d’études interventionnelles.
Action 2 : En interagissant avec les organismes de surveillance dans le domaine humain (Santé publique France), animal (ANSES) et environnemental (AFB, INERIS), nous mettrons en place une recherche méthodologique afin d’optimiser le recueil des données de surveillance de la résistance aux antibiotiques et de la consommation des antibiotiques ainsi que la collecte et la conservation de souches bactériennes. L’objectif sera de permettre une meilleure intégration des données provenant des trois secteurs afin de caractériser les voies d’émergences et de transmission.
Action 3 : La résistance aux antibiotiques est une problématique globale avec la circulation planétaire de BMR et de gènes de résistance via divers éléments génétiques. Nous favoriserons les collaborations dans le cadre de réseaux internationaux et l’analyse de l’impact des échanges internationaux. Les partenariats avec des pays à bas ou moyen niveau de revenus seront en particulier favorisés.
Action 4 : Nous créerons un guichet unique de biobanques de souches bactériennes notamment de BMR, de supports génétiques et de vecteurs de résistance. Nous développerons des bases de données « omiques » (génomes complets bactériens, resistome, données métagénomiques de matrices complexes – tissus ou liquides biologiques humains ou animaux, matrices environnementales – données transcriptomiques, métabolomiques…) à partir des trois écosystèmes HAE qui seront accessibles pour la recherche en prenant en compte toutes les contraintes de confidentialité (en collaboration avec l’axe 3).
Action 5 : Nous développerons des marqueurs de résistance quantifiables permettant d’évaluer l’importance des différentes voies de dissémination de l’antibiorésistance (hôpitaux, contacts directs, flux internationaux de personnes et de biens de consommation, chaîne alimentaire humaine, alimentation des animaux de production, traitements des eaux usées, épandages-fumiers, faune sauvage, circulation de biofilms sur déchets plastiques…) au sein et entre les écosystèmes HAE.
Action 6 : Nous développerons de nouvelles méthodes de modélisation de la transmission et de l’émergence faisant notamment appel aux technologies d’apprentissage basées sur l’intelligence artificielle (ex. « machine learning », « deep learning ») et qui incorporeront les données acquises dans les objectifs 2 et 3 de l’axe 1.
Indicateurs
- Mise à disposition d’outils standardisés et accessibles à une large communauté d’acteurs des mondes scientifique et socio-économique permettant d’analyser et comparer finement les voies de dissémination pour aller au-delà des réseaux de surveillance (humain et animal) existant actuellement et permettant de mesurer les effets de mesures de prévention.
- Mise à disposition à 5 ans de banques de données microbiologiques et « omiques » spécifiques de la résistance des trois écosystèmes HAE, exploitables par la communauté scientifique.
- Mise à disposition d’outils mathématiques et informatiques pour modéliser les phénomènes d’émergence, d’évolution et de transmission de la résistance aux antibiotiques ainsi que l’impact d’interventions.
- Modélisation de l’émergence et de la dissémination des clones BMR hyperépidémiques et des gènes et de leur capacité de transmission intersectorielle.
- Identification de réservoirs environnementaux des gènes de résistance majeurs en médecine humaine et vétérinaire et des dynamiques d’échange.
Objectif 2 • Améliorer les traitements des infections bactériennes par l’identification de phénomènes d’échappement aux traitements antibiotiques par des mécanismes bactériens ou résultant des interactions avec l’hôte.
Action 7 : Nous développerons des modèles d’étude pertinents in vitro, in vivo & ex vivo afin de mettre en évidence des mécanismes spécifiques de résistance aux antibiotiques et aux antiseptiques et d’échappement aux traitements dans les différents environnements. Ces données seront combinées aux données cliniques et microbiologiques obtenues dans des situations d’échec thérapeutique.
Action 8 : Nous rechercherons les bases génétiques de la résistance et de l’échappement aux traitements (biofilm, persistance, tolérance, bactéries non cultivables…), afin de comprendre les mécanismes moléculaires, identifier de nouvelles cibles bactériennes et optimiser les traitements et leur association.
Action 9 : Nous déterminerons les facteurs de l’hôte contribuant à l’efficacité des traitements : facteurs génétiques et immunitaires, pathologies sous-jacentes, accessibilité du site infectieux, composition des microbiotes.
Indicateurs
- Méthodes validées et protocoles de référence pour corréler doses d’antibiotique et efficacité du traitement.
- Identification de nouvelles cibles bactériennes.
- Identification de biomarqueurs d’efficacité du traitement et de risque de sélection de résistance pour un traitement personnalisé des infections longues et/ou récurrentes.
Objectif 3 • Stopper l’augmentation de la résistance et inverser la courbe.
Action 10 : Nous définirons la dynamique spatiale et temporelle d’acquisition de la résistance aux antibiotiques par les bactéries, les avantages écologiques et modes de transmission de clones bactériens résistants disséminés, des gènes de résistance et des supports génétiques de résistance. Les approches pluridisciplinaires impliquant microbiologie clinique et moléculaire, écologie microbienne, épidémiologie, modélisation et intelligence artificielle seront favorisées. L’effet des antibiotiques et les biocides dans les trois secteurs HAE et notamment à l’hôpital sur la sélection et la dissémination de la résistance sera analysé pour caractériser leur impact et aider au design et à la modélisation d’intervention (Axe 4).
Action 11 : Nous identifierons les mécanismes de résistance aux nouveaux antibiotiques et leur potentiel de transfert vers les bactéries pathogènes par criblage de différents échantillons provenant des trois secteurs de différents pays. Nous identifierons ainsi les niches à risque permettant la mise en place de mesures de prévention de leur dissémination.
Action 12 : Nous développerons des méthodes innovantes pour bloquer la transmission des gènes de résistance. Nous caractériserons pour cela les bases moléculaires de la capture des gènes de résistance notamment à partir de bactéries de l’environnement, leur incorporation dans des éléments génétiques mobiles (ex. plasmides, transposons, intégrons) et leur transmission dans les trois secteurs HAE. Nous définirons les interactions entre gènes de résistance, éléments génétiques mobiles et bactéries-hôtes contribuant à leur dissémination.
Action 13 : Nous développerons des procédés innovants pour prévenir la dissémination des antibiotiques et biocides contre les bactéries dans les environnements, et des analyses pour évaluer leur impact.
Indicateurs
- Recommandations dans l’usage des antibiotiques, mais également dans les stratégies de contrôle et prévention des infections, la gestion des effluents ou l’organisation des élevages, pour prévenir la transmission, la colonisation et la dissémination des clones à risque.
- Stratégies innovantes « anti-transfert » des gènes de résistance et de décontamination des environnements par les antibiotiques et les biocides.
Stratégies innovantes « anti-transfert » des gènes de résistance et de décontamination des environnements par les antibiotiques et les biocides.
Axe 2 • Approches des SHS, épidémiologiques et interventionnelles de l’antibiorésistance chez l’être humain, les animaux et dans l’environnement
Contexte
Les usages d’antibiotiques, de leur production à leur utilisation finale, en passant par leur prescription et leur délivrance, sont aujourd’hui extrêmement variés, tout comme les différents dispositifs visant à les encadrer. Il importe donc de mieux comprendre les logiques qui conduisent à un mésusage des antibiotiques, et d’identifier les dynamiques favorisant de meilleures pratiques de prescription et d’utilisation. Aussi, lutter contre l’antibiorésistance nécessite :
- d’analyser, comprendre et décrire les déterminants contextuels et les facteurs sociaux, de repérer les logiques économiques, les pratiques individuelles ou professionnelles, les cadres juridiques, les discours, et les situations, liés à cette question ainsi que d’observer les groupes de population concernés, les lieux de décision, et les espaces de mise en visibilité du problème de l’antibiorésistance et du bon usage des antibiotiques ;
- de réduire l’utilisation des antibiotiques en médecine humaine et vétérinaire au strict nécessaire, d’en contrôler l’usage, et d’en promouvoir un usage prudent/responsable/approprié dans le cadre de Programmes de bon usage des antibiotiques (Antibiotic stewardship programmes) ;
- de lutter contre la transmission des bactéries pathogènes (sensibles ou résistantes) et des gènes de résistance. Ces actions devant être déclinées à la fois dans la communauté, les établissements médicosociaux et dans les établissements de soins/santé. Les programmes hospitaliers de contrôle de l’infection répondent à ce dernier point pour les activités de routine mais leurs limites soulignent la nécessité de développer des projets de recherche sur cette thématique.
Enjeux
Les objectifs de recherche devront intégrer des questions liées aux sciences humaines et sociales (SHS), aux interventions liées à la prescription au sens large et aux mesures de prévention. Ils traiteront de la compréhension et de l’analyse des situations/contextes/pratiques et discours, et seront orientés vers les interventions. Ils reposeront pour cette partie qui cible la compréhension et l’analyse, sur des concepts maîtrisés dans le champ des SHS mais pas exclusivement. Ils concerneront également les programmes de bon usage des antibiotiques et du contrôle de l’infection liée à des bactéries résistantes, et incluront notamment des approches interventionnelles ou d’épidémiologie quantitative. Les interventions concourant à la maîtrise de la résistance aux antibiotiques au sens large (prescription, transmission, impact individuel et collectif, etc.) devront reposer sur différents designs méthodologiques. Enfin, les études intégrant une dimension internationale et comparative seront vivement encouragées.
Priorités de recherche
Analyser, décrire, comprendre
- Savoirs, informations, communications et pratiques
Un premier enjeu concerne la perception du risque de l’antibiorésistance dans différents contextes : à l’hôpital, en médecine de ville ou vétérinaire (rurale ou des animaux de compagnie). Cet enjeu concerne le degré de conscientisation (awareness) des acteurs concernés (professionnels de santé, patients ou les propriétaires d’animaux), et interroge les niveaux d’informations disponibles, leur circulation ainsi que les formes de communication sur l’antibiorésistance. - Dynamiques professionnelles et organisationnelles
Les usages des antibiotiques sont largement dépendants des contextes professionnels dans lesquels ils s’inscrivent. Les restructurations de l’hôpital, comme des filières agroalimentaires, les conditions de travail des soignants, l’évolution des professions médicales et vétérinaires ont-elles un impact sur les usages des antibiotiques ? Dans quelle mesure ces transformations structurelles influencent-elles les conditions de prescription et d’utilisation des antibiotiques ? D’un autre côté, les mesures de prévention prises à l’égard des malades victimes de bactéries résistantes en milieu hospitalier, ont des conséquences qu’il importe d’analyser.
- Enjeux économiques et écologiques
Différents enjeux sont au croisement d’intérêts multiples, qui concernent aussi bien la production et la commercialisation d’anciens ou nouveaux antibiotiques, comme des innovations thérapeutiques. Le modèle économique des antibiotiques, constitue en soi un enjeu économique crucial qui dépasse les calculs de coût directs de consommation. D’autres enjeux concernent la manière dont les élevages et les entreprises agro-alimentaires sont confrontés à une transformation des demandes des consommateurs. Enfin, la question des rejets (industriels, hospitaliers, agricoles) s’avère cruciale. - Action publique et régulations
La manière dont le problème de l’antibiorésistance s’est imposé dans le débat public, et dont cela a influencé la mise en oeuvre de politiques publiques constitue un enjeu qui se décline de manière spécifique dans chaque pays en fonction de son histoire, de sa culture et des acteurs concernés. Les effets de ces politiques publiques interrogent la définition des mesures les mieux adaptées pour encourager une réduction durable de la consommation d’antibiotiques et des infections liées aux bactéries résistantes.
Contrôle et prévention de la diffusion des bactéries résistantes aux antibiotiques
L’émergence et la propagation de la résistance aux antibiotiques est un problème majeur de santé publique confirmé par l’augmentation de l’incidence de ces infections ou colonisations. En particulier, les patients hospitalisés dans des unités de soins intensifs sont fortement exposés aux infections nosocomiales liées aux bactéries hautement résistantes émergentes (BHRe). Par exemple, le taux de mortalité lié aux bactériémies dans ces services varie de 25 % à 30 %.
Les BHRe, incluant les entérobactéries productrices de carbapénémases (EPC) et Enterococcus faecium résistant aux glycopeptides (ERG), sont des bactéries commensales du tube digestif à forte capacité de diffusion et représentent un problème majeur de santé publique à l’échelle nationale et mondiale comme l’OMS et diverses sociétés savantes l’ont souligné. En France, 2 385 épisodes à EPC ont été signalés à l’Institut de Veille sanitaire entre 2004 et décembre 2015. Klebsiella pneumoniae est l’espèce bactérienne la plus fréquemment isolée ; pourtant, moins de 1 % des souches isolées sont résistantes aux carbapénèmes. Dans d’autres pays européens tels que la Grèce et l’Italie, le niveau de résistance est de 61,9 % et 33,5 % respectivement. En France, la détection rapide des BHRe et la mise en place précoce de mesures pour prévenir leur diffusion sont recommandées par le Haut Conseil de la santé publique (HCSP), il s’agit également d’un axe important du Programme national d’actions de prévention des infections associées aux soins (Propias).
Ces mesures de prévention sont contraignantes pour les patients infectés ou colonisés mais aussi pour les établissements de soins. Elles imposent notamment de dépister l’ensemble des patients dits contacts (= patients pris en charge par la même équipe soignante en l’absence d’isolement immédiat du cas index) et peuvent conduire à l’arrêt des admissions et transferts de patients. L’isolement du patient, ayant pour but de limiter le risque de transmission croisée, a pour conséquence un impact psychologique, la réduction de la fréquence des visites des soignants et la survenue d’évènements indésirables non détectés pour le patient porteur. Une augmentation des délais de transfert est aussi classique et des refus de transferts ne sont pas rares. Leurs conséquences sur les autres patients du service concerné sont inconnues à ce jour. L’impact peut aussi atteindre d’autres établissements de proximité de l’établissement atteint. Par ailleurs le système de financement des établissements lié à l’activité (T2A) repose sur un turnover important de patients. Tout événement susceptible d’altérer la fluidité des soins entraîne automatiquement une réduction des ressources financières. Aussi, en cas d’alerte épidémique, deux paradigmes tendent à s’opposer puisque la réduction des admissions et transferts est conseillée mais générera une perte de ressources financières.
Intervenir
- Études observationnelles
Développer des outils de mesure/indicateurs utilisables en routine à large échelle pour évaluer l’efficacité d’interventions visant à améliorer les pratiques antibiotiques et réduire le risque épidémique. Par exemple, pouvoir mesurer en routine de manière automatisée en France la qualité des pratiques antibiotiques via les remboursements de l’Assurance maladie.
- Études interventionnelles
Ces études interventionnelles ont pour objectif une amélioration des pratiques (programmes de bon usage des antibiotiques/antibiotic stewardship programmes ou programmes de contrôle de l’infection/infection control programmes), pour in fine réduire l’antibiorésistance. Elles doivent utiliser un design à haut niveau de preuve, comme par exemple un design par cluster randomisé ou quasi-expérimental (avec groupe contrôle et analyse par séries chronologiques). Une évaluation des freins et facilitateurs, ainsi qu’une analyse de processus (cf. méthodologie des interventions complexes) sont fortement recommandées. Les critères de jugement doivent avoir une pertinence clinique et intégrer la dimension « qualité des pratiques » D’autres critères de jugement pourront aussi être proposés comme l’impact médico-économique, la perte de chance, la sinistralité, les impacts médico-légaux, l’impact de la formation, etc. Ces interventions (population générale, population hospitalisée, médecine vétérinaire, prescripteurs, monde agricole, médias, autres acteurs…) nécessiteront à ce titre une définition rigoureuse des critères de jugement. Des indicateurs de résultats concernant l’aspect « coût-efficacité » seront particulièrement attendus. Ces interventions pourront être déclinées dans différents contextes incluant des travaux collaboratifs avec des pays émergents.
- L’antibiotic stewardship
Il s’agit d’une stratégie globale dont l’objectif est d’assurer et promouvoir un usage responsable et approprié des antibiotiques. On traduit en général le terme par « programmes de bon usage des antibiotiques » en français, mais cette expression est plus réductrice que l’expression en anglais (https://www.ncbi.nlm.nih.gov/pubmed/28882725). L’antibiotic stewardship utilise une approche large et va s’intéresser à l’organisation de la société en général, l’organisation du système visé (santé humaine/animale, environnement), les professionnels du secteur visé (santé humaine/animale, environnement) dans leur ensemble (qu’ils soient prescripteurs ou non d’antibiotiques), les utilisateurs d’antibiotiques (patients en santé humaine et éleveurs en médecine vétérinaire) et les usagers. L’antibiotic stewardship s’applique aux champs de la médecine humaine, de la médecine vétérinaire, et de l’utilisation des antibiotiques dans l’environnement (par exemple en agriculture), dans une perspective « Une seule santé ».
- Contrôle de la diffusion et prévention
Le contrôle de la diffusion de bactéries résistantes aux antibiotiques nécessite des mesures appropriées et rigoureuses. Ces mesures s’appliquent au contexte hospitalier mais aussi sous des formes différentes en dehors des établissements de santé. Pour autant, la plupart d’entre elles reposent sur des résultats dont le niveau de preuve n’est pas toujours satisfaisant et qui n’intègrent que très rarement une approche coût-efficacité. Il s’agira de faire émerger des projets concernant l’impact de la mise en place de ces mesures incluant des facteurs sociaux et de comportement. Les contextes endémiques et épidémiques pourront être investigués. Des études bien conduites reposant sur des interventions solides mais dont les résultats sont négatifs devront aussi être rapportées. Le contrôle de la diffusion s’applique aux champs de la médecine humaine, de la médecine vétérinaire, et de l’environnement (agriculture, stations d’épuration des eaux usées…), dans une perspective « Une seule santé ». Comme mentionné dans le champ « Analyser, décrire, comprendre », les interventions devront clairement évaluer l’impact de la résistance aux antibiotiques et des mesures de prévention pour contrôler la diffusion, l’accès aux soins, l’organisation des soins, et la perte de chance pour les patients qu’ils soient porteurs ou non de bactéries résistantes aux antibiotiques.
Objectifs et plan d’actions
Principe général
Les problématiques relevant des Sciences humaines et sociales (SHS), de la santé publique et de l’épidémiologie s’articulent autour de 3 objectifs principaux :
- mettre en place un réseau d’analyse des discours, des pratiques, et des usages liés aux antibiotiques et à l’antibiorésistance et se focaliser dans un premier temps sur : le système socio-économique, le contexte culturel et environnemental, ainsi que les dispositifs socio-techniques dans le monde humain et animal qui permettent de comprendre les racines socio-culturelles et contextuelles de l’antibiorésistance. Ceci inclut aussi les « comportements » des acteurs et surtout les interactions soignants-malade, vétérinaire-animal, éleveur-animal qui conduisent à la prescription,
- évaluer des mesures de contrôle et de prévention sur la diffusion des bactéries résistantes aux antibiotiques et hautement résistantes émergentes, et des effets indésirables potentiels au niveau individuel et organisationnel,
- développer des études interventionnelles dans le domaine de l’Antibiotic Stewardship afin d’assurer et promouvoir un usage responsable et approprié des antibiotiques.
Objectif 1 • Mettre en place un réseau d’analyse, des discours, des pratiques, et des usages liés aux antibiotiques et à l’antibiorésistance dans une perspective One Heath.
Il s’agit d’analyser, comprendre, et décrire les facteurs contextuels, et les conditions socio-culturelles, de repérer les logiques économiques, les pratiques individuelles ou professionnelles, les situations, les cadres juridiques, les discours et les langages, liés aux usages des antibiotiques et au développement des résistances bactériennes. Il s’agit aussi d’observer les groupes sociaux concernés, les lieux de décision, et les espaces de mise en visibilité du problème de l’antibiorésistance, ainsi que de mettre en perspective historiques les pratiques et les usages. Ces recherches nécessitent la mise en réseau de chercheurs relevant de différentes disciplines au sein des SHS (sociologie, sciences politiques, sciences de l’information et de la communication, linguistique, anthropologie, sciences économiques, histoire, géographie, etc.) qui pourront collaborer avec des chercheurs du monde de la santé humaine, animale et environnementale afin de constituer des réservoirs de compétences mobilisables sur toutes les facettes du problème de l’antibiorésistance. De plus, cet observatoire pourra constituer une ressource pour la gestion de crises éventuelles, tant au niveau de l’observation des seuils d’alerte, de l’information, de la communication, ou des interactions avec les décideurs publics ou privés. L’objectif principal est donc la constitution d’une communauté académique dont les actions de recherche pourront être regroupées autour des quatre thématiques qui suivent.
Action 14 : Nous étudierons la diffusion et la circulation de l’information, des savoirs, et la communication. La communication sur l’antibiorésistance soulève de multiples questions qui renvoient à la définition même de ce qu’est la communication, et interrogent les informations, connaissances et savoirs qu’elle rend visibles et publics. On étudiera les savoirs à la fois professionnels et profanes qui président aux usages des antibiotiques tant en santé humaine qu’animale, et la connaissance de leur impact sur l’environnement dans divers contextes culturels. On s’intéressera aux cadres d’interprétation, et aux concepts (tels que « Une seule santé ») qui sous-tendent la publicisation des connaissances, des informations et des représentations. L’attention des chercheurs portera aussi bien sur les actions, les discours et les images, que sur le rôle joué par les médias et par les réseaux sociaux. Le traitement et la production des données numériques s’inscrit aussi dans une dynamique plus large de production et de mise en circulation des connaissances qui mérite attention.
Indicateurs
- Augmentation de la communication et élargissement des espaces de communication.
- Amélioration des messages et campagnes d’information (empowerment).
- Hausse de la prise de conscience du public
Action 15 : Nous étudierons les pratiques, le travail et les organisations. Il conviendra de prendre en compte l’effet des contextes professionnels et organisationnels sur les usages des antibiotiques. Les restructurations de l’hôpital comme des filières agro-alimentaires impactent les pratiques des soignants et des intervenants en élevage, transforment leurs métiers et leurs modes de travail, et reconfigurent in fine leur manière d’utiliser les antibiotiques et/ou leurs alternatives. Comment évoluent les professions médicales (en ville ou en contexte hospitalier) et vétérinaires, et quel impact ces évolutions ont-elles sur les usages d’antibiotiques ? Quels savoirs sont mobilisés dans les pratiques d’utilisation des antibiotiques et de leurs alternatives ? Quels dispositifs sociotechniques et modes d’organisation (systèmes d’élevage, types de cabinets médicaux et vétérinaires, etc.) favorisent un usage raisonné ? Quelles interactions et quelles formes de contractualisation entre les professionnels de santé et leurs patients/clients sont à même de mieux encadrer la prescription d’antibiotiques ? On s’intéressera dans ces contextes, aux usages et effets de nouveaux outils numériques, tant pour le diagnostic que la surveillance.
Indicateurs
- Baisser le nombre de prescriptions.
- Mettre en place des mesures de prévention et des mesures alternatives.
- Prise en compte de ces données dans la réorganisation des systèmes de santé.
Action 16 : Nous analyserons les enjeux économiques et écologiques. Le développement et l’utilisation des antibiotiques comme de leurs alternatives, s’inscrivent dans des contextes économiques et marchands qui peuvent en favoriser, ou au contraire, en restreindre l’utilisation. En santé humaine, les stratégies des industries pharmaceutiques comme les questions relatives à la prise en charge par l’Assurance maladie des alternatives aux antibiotiques, constituent un enjeu important. En santé animale, l’évolution du marché des médicaments vétérinaires (production, distribution, vente, etc.) demande à être observée. Dans l’environnement, l’impact écologique des rejets (industriels, hospitaliers, agricoles, etc.) doit être évalué en termes de coût écologique aussi bien que financier ainsi que l’impact de changement climatique sur le phénomène global de la résistance des bactéries aux antibiotiques. Ces études doivent accompagner la transition économique et écologique des systèmes agro-alimentaires et la mise en oeuvre d’un usage durable des antibiotiques.
De même, on étudiera au niveau de l’alimentation, la mise en place de labels et de signes de qualité spécifiques pour les produits dits « sans antibiotiques » contribuant à la transformation d’usages qui sont aussi tributaires des consommateurs, et des positionnements des entreprises privées (industries agro-alimentaires, distribution, restauration, etc.).
Plus largement, des études sur l’impact économique et le coût de l’antibiorésistance sont également attendues, ainsi qu’une réflexion plus générale sur l’économie des antibiotiques et ses spécificités (enjeux, modèles économiques et marchands).
Indicateurs
- Promotion d’un usage durable des antibiotiques et des alternatives.
- Multiplication des incentives (pour stimuler la R&D, la prescription d’alternatives et les modes de production sans antibiotiques) afin d’accompagner la transition écologique des systèmes agro-alimentaires.
- Baisse des usages et des AMR.
- Baisse de l’impact économique et écologique global de l’AMR.
Action 17 : Nous étudierons les formes d’action publique et de régulation. Il importe de comprendre les formes de cadrage, ainsi que les racines historiques et culturelles des politiques publiques visant à réduire l’utilisation des antibiotiques, et d’en évaluer l’impact. Comment le problème de l’antibiorésistance s’est-il imposé dans le débat public ? Quel rôle ont joué les médias et la communication dans ces processus ? Quels sont les acteurs, et les instruments de lutte de l’action publique contre l’antibiorésistance ? Quels sont les effets de ces politiques publiques et quelles mesures paraissent les mieux adaptées pour encourager une réduction durable des usages d’antibiotiques, ainsi qu’une réduction des infections liées aux bactéries résistantes ? Quels enjeux éthiques soulèvent-elles ?
Une réflexion sur les dimensions juridiques du problème est aussi attendue (législation de la prescription/dispensation du conseil en antibiothérapie…).
Indicateurs
- Mise en oeuvre de politiques publiques adaptées aux mutations socio-économiques et culturelles contemporaines.
- Développement d’instruments de communication et de régulation innovants.
- Baisse des usages et des AMR.
Objectif 2 • Évaluer les mesures de contrôle et de prévention sur la diffusion des bactéries résistantes aux antibiotiques et hautement résistantes émergentes, et les effets indésirables potentiels au niveau individuel et organisationnel incluant la médecine vétérinaire.
Il s’agira de confirmer l’efficacité des mesures de prévention préconisées ou d’identifier de nouvelles approches préventives, d’explorer l’impact de ces mesures de contrôle de l’infection sur une possible perte de chance pour un patient colonisé ou infecté par une ou des bactéries résistantes aux antibiotiques et documenter une désorganisation de l’offre de soins au niveau de l’unité concernée.
Action 18 : Nous mettrons en place des études interventionnelles visant à lutter contre la transmission des bactéries pathogènes (sensibles ou résistantes) et des gènes de résistance et à améliorer la surveillance épidémiologique. Ces actions devant être déclinées, pour la santé humaine : à la fois dans la communauté, les établissements médico-sociaux et dans les établissements de santé ; pour la santé animale : dans les élevages, les circuits de circulation des animaux, les lieux d’abattage ou de première collecte des produits animaux, les cabinets vétérinaires ; et, pour la santé environnementale : dans les stations d’épuration et zones d’épandage des effluents.
Ces études seront intégrées dans le cadre de programmes de contrôles des infections pour la santé humaine et devront être préférentiellement des études expérimentales ou quasi-expérimentales. Elles devront permettre de mesurer, dans un contexte hospitalier, la réduction de la transmission croisée des BMR ou BHRe liée à l’application des mesures préventives appropriées (précautions particulières, isolement, cohorting, etc.) et d’évaluer la faisabilité et l’impact de mesures de prévention innovantes sur de la diffusion selon différents contextes géographiques, hospitaliers ou de soins, tels que la pédiatrie ou les EHPAD.
Proposer une/des stratégie-s innovantes de surveillance épidémiologique adaptée (en lien avec l’axe 1) permettant de décrire le continuum entre établissements de santé et médecine de ville concernant BMR/BHRe dans les établissements de soins et la médecine de ville. Concernant les établissements de santé, le développement d’outils informatiques adaptés intégrant, entre autre, des données cliniques, microbiologiques, de pharmacie, et de mobilité/transfert de patients au sein des établissements devrait permettre à la fois une détection précoce des alertes mais aussi faciliter la gestion en routine des cas de BMR/BHRe (cas index, cas secondaires en cas d’épidémie, etc.). Ces outils pourraient aussi convenir dans une moindre mesure à un maillage régional ou national permettant de décrire et d’anticiper le cas échéant certaines tendances ou menaces épidémiologiques. Pour ce faire, les outils s’appuieront notamment sur le Health Data Hub, infrastructure nationale en cours de mise en place qui devrait permettre d’extraire et chaîner les données de source hospitalière, de médecine de ville ou de résultats d’analyses biologiques. À terme, les initiatives ou méthodologies nouvelles de surveillance épidémiologiques pourraient trouver leur déclinaison de routine avec les agences nationales concernées.
Une analyse coût-bénéfice sera à même de produire des résultats qui guideront le contenu de recommandations adaptées incluant une évaluation médico-économique des stratégies de dépistage des BMR/BHRe (dépistage d’un cas index et autour d’un cas index).
Certaines des actions citées plus haut auront vocation à être proposées dans différents contextes géographiques incluant des collaborations internationales. Pour la santé animale, des stratégies innovantes de surveillance et de prévention seront proposées en distinguant le contexte des animaux de compagnie de celui des animaux d’élevage, et en considérant les circuits de circulation et les possibilités d’échange de résistances bactériennes entre microbiotes. Pour la santé environnementale, il en sera de même en distinguant le contexte des effluents de ville, des effluents industriels et des effluents d’élevage.
Indicateurs
- Réduction de cas de transmission/cas secondaires de patients BMR/BHRe intra hospitaliers et dans les structures vétérinaires ; mise en place d’outils informatiques de surveillance adaptés et études pilotes ; estimation des coûts directs des cas (et témoins ou contrôles) porteurs de BMR/BHRe.
- Persistance de la réduction de la transmission.
- Capacité de détection de manière valide des données endémiques et épidémiques incluant : – description des « interactions » ville-établissements de santé-secteurs vétérinaire et environnemental en matière de BMR/BHRe (souches de BMR communautaires apparaissant en établissement et inversement) ; résultats d’analyses coût/bénéfice. – identification de facteurs favorables/défavorables à la circulation des résistances et de leur transfert entre différents microbiotes humain, animal et environnemental.
- Réduction confirmée de la diffusion ; proposition de recommandations hospitalières et en médecine de ville, ainsi qu’en médecine vétérinaire, et pour la gestion des effluents de différents types ; flexibilité du système de surveillance en fonction de nouvelles tendances épidémiologiques.
Action 19 : Estimer l’effet de la gestion des épisodes (isolés ou épidémiques) hospitaliers de BMR/BHRe sur le risque de perte de chance chez les patients porteurs, les contacts et les autres patients.
Indicateurs
- Dénombrer le nombre (proportion) de situations de perte de chance, décrire les types de pertes de chance.
- Nombre d’événements perte de chance au cours du temps et types.
- Réduction du nombre de pertes de chance.
Action 20 : Estimer l’effet de manière agrégée à l’échelle de l’unité de soins, et de l’établissement, de la prise en charge des épisodes de BMR/BHRe sur l’accès aux soins des patients porteurs de BHRe, contacts et des autres patients des services concernés. Cette évaluation comportera l’étude des retards à la mutation/transfert des patients, les retards à l’hospitalisation, les déprogrammations, et les sorties précoces inadaptées. La charge en soins sera aussi à quantifier et permettra de calculer les ressources hospitalières consommées dans ces contextes qui pourront être comparés à des soins en l’absence de patient porteur de BMR/BHRe. L’évaluation de l’activité complètera ces informations si elle est disponible. Ces actions permettront d’anticiper des conséquences d’alertes futures et d’adapter le système de soins à des émergences de BMR.
Indicateurs
- Impact de la gestion des cas de BMR/BHRe sur l’organisation de soins, quantifier les ressources hospitalières consommées.
- Adaptation du management et de l’organisation des services de soins, maintien de l’activité attendue ou impacts contrôlé des méthodes de contrôle sur l’offre de soins.
- Recommandation de gestions adaptées de la prise en charge des patients permettant un contrôle de la diffusion des BMR/BHRe sans altération de l’offre de soins quels que soient le type de patient (indemnes, contacts, cas) et la population (pédiatrie, adultes, âge avancé).
Objectif 3 • Développer des études interventionnelles dans le domaine de l’Antibiotic Stewardship afin d’assurer et promouvoir un usage responsable et approprié des antibiotiques.
L’intervention est une stratégie uni- ou multimodale (e.g. audit et feedback, éducation, modification de l’organisation des soins…) qui vise à améliorer la qualité de l’usage des antibiotiques (prescription, dispensation, utilisation). On s’intéresse ici au « HOW » de l’Antibiotic Stewardship (une stratégie visant à améliorer la qualité des antibiothérapies, e.g. éducation), et pas au « WHAT » (la définition de ce qu’est une antibiothérapie appropriée, e.g. déterminer la durée optimale d’antibiothérapie en termes d’efficacité et de risque d’antibiorésistance) (cf. PMID: 28750920). L’étude des déterminants de la prescription/dispensation/utilisation des antibiotiques (cf. Objectif 1) est un prérequis précieux pour adapter au mieux la stratégie interventionnelle.
Action 21 : Nous mettrons en place des études interventionnelles permettant de réduire l’utilisation des antibiotiques en médecine humaine et vétérinaire au strict nécessaire, d’en contrôler l’usage, et d’en promouvoir un usage prudent/responsable/approprié (Antibiotic stewardship programmes/Programmes de bon usage des antibiotiques). Ces études interventionnelles ont pour objectif une amélioration des pratiques (Programmes de bon usage des antibiotiques/Antibiotic Stewardship Programmes), pour in fine réduire l’antibiorésistance. Les interventions doivent utiliser un design à haut niveau de preuve comme, par exemple, un design cluster randomized ou quasi-expérimental (avec groupe contrôle et analyse par séries chronologiques). Une évaluation des freins et facilitateurs, ainsi qu’une analyse de processus (cf. méthodologie des interventions complexes) sont fortement recommandées. Les critères de jugement doivent avoir une pertinence clinique (cf. PMID: 29133158). La constitution d’un comité scientifique pluridisciplinaire (e.g. chercheurs issus du monde de la santé et des sciences sociales) est fortement recommandée. Ces interventions peuvent avoir plusieurs cibles : population générale, population hospitalisée, médecine vétérinaire, prescripteurs, monde agricole, médias, autres acteurs… Pour la médecine humaine et vétérinaire, tous les secteurs (établissements de santé, établissements médico-sociaux, ville) et toutes les spécialités (médecine générale, autres spécialités…) sont visés.
Indicateurs
- Nombre d’études interventionnelles sur Antibiotic Stewardship financées
- Nombre d’interventions innovantes validées par ces études financées, avec un haut niveau de preuve (cf. critères EPOC).
- Réduction de la consommation d’antibiotiques et augmentation de la prévalence d’antibiothérapies appropriées en France suite à la mise en place de ces interventions innovantes.
Axe 3 • Innovations technologiques appliquées à l’antibiorésistance dans les domaines du numérique, du diagnostic et de la thérapie
Contexte
L’innovation technologique occupe une position centrale dans le domaine de la santé et se déclinera dans ce plan en trois grands domaines : données massives et intelligence artificielle, diagnostic, innovation thérapeutique.
Il n’y a actuellement pas de solution « sur étagère » pour résoudre la question de l’AMR et des efforts massifs de recherche sont nécessaires. C’est un champ peu exploré en termes d’innovations technologiques alors que des innovations de rupture y sont nécessaires et attendues. Dans le domaine du diagnostic, ces innovations en interaction avec les axes 1 et 2, permettront une utilisation raisonnée des antibiotiques, une meilleure prise en charge et plus rapide des patients à traiter, l’isolement à l’hôpital de patients porteurs de bactéries multi-résistantes (pour éviter leur propagation), l’identification de nouvelles résistances et une meilleure compréhension de leurs mécanismes, et la surveillance de la propagation de ces phénomènes de résistance. Dans le domaine thérapeutique en interaction avec l’axe 4, ces innovations permettront de développer de nouvelles molécules ou de nouvelles combinaisons ainsi que de repositionner d’anciennes molécules devenues inefficaces. Elles permettront également de combiner antibiothérapie et des stratégies alternatives dans le domaine de la médecine humaine et vétérinaire.
Enjeux
Données massives et intelligence artificielle
L’utilisation des données observationnelles, en vie réelle, produites en routine de façon de plus en plus systématique et standardisée par le système de soins, doit permettre d’avoir une vision actualisée et prospective de l’état des résistances aux antibiotiques par le développement d’outils nouveaux de surveillance. Il sera entre autres possible de tracer les souches résistantes.
Ces outils seront également indispensables pour connaître l’usage réel qui est fait des médicaments et pour quelles pathologies, en médecine humaine, en ville ou à l’hôpital, notamment à l’aide du Système national des données de santé (SNDS), en médecine vétérinaire et pour évaluer les rejets dans l’environnement.
En relation avec des travaux de terrain, les méthodes de machine learning doivent guider l’utilisation la plus adaptée possible de l’antibiothérapie notamment par l’aide à l’interprétation des résultats des tests diagnostiques et l’utilisation d’algorithmes décisionnels pour la prescription, et ainsi diminuer toutes les utilisations antibiotiques qui ne sont pas nécessaires.
Dans cette même perspective et en interaction avec l’axe 1, l’application des méthodes récemment développées devra permettre d’avancer vers une médecine personnalisée par une utilisation des données génomiques du patient et des bactéries qui l’affectent.
Enfin, ces méthodes devraient plus généralement enrichir l’analyse et l’utilisation plus efficace et performante de certains des très nombreux champs qui génèrent des données massives au sein des autres axes.
Innovation dans le domaine du diagnostic
Un enjeu majeur concerne le développement de tests permettant de définir le plus rapidement possible le type d’infections, la bactérie impliquée et le type de résistance aux antibiotiques.
Pour limiter les prescriptions abusives d’antibiotiques et choisir le bon traitement, il est nécessaire de différencier rapidement une infection bactérienne de tout autre type d’infection. Ce test existe déjà en cabinet médical pour l’identification spécifique des angines à streptocoques et a montré son utilité dans la rationalisation de la prescription antibiotique. Il convient maintenant d’élargir ces applications à différentes pathologies et échantillons biologiques et d’identifier les biomarqueurs spécifiques associés. En cas d’infection bactérienne, l’identification de l’espèce n’est possible qu’après une étape de culture sur gélose et se fait le plus souvent en spectrométrie de masse (Maldi-Tof). Enfin, une fois l’espèce identifiée, l’identification de possibles résistances aux antibiotiques par des tests de susceptibilité nécessite une étape supplémentaire de culture. Il conviendra de développer des tests plus rapides permettant une identification de l’espèce ainsi que de la susceptibilité aux antibiotiques en raccourcissant ou en s’affranchissant de l’étape de culture. L’impact clinique de ces tests devra être évalué.
Ces tests doivent le plus possible être adaptés à des concepts d’emploi « terrain » et « Point of Care/Point of Need », ces derniers s’approchant au maximum du test idéal défini par l’OMS comme «ASSURED» (Affordable, Sensitive, Specific, User-friendly, Rapid and robust, Equipment free and Deliverable) pour une utilisation dans les pays à faible revenu (sans infrastructure) ou dans les pays à revenus élevés (médecine de ville).
Parallèlement, le développement de tests demandant une technicité plus élevée apportera un niveau de précision supérieur et permettra leur utilisation pour l’identification de nouveaux biomarqueurs et l’émergence de nouvelles résistances.
L’intégration de technologies de rupture dans le développement des tests, utilisant des approches microfluidiques, digitales, biosenseurs, biologie synthétique, etc. permettra d’augmenter leur sensibilité pour idéalement obtenir un résultat directement sur échantillons cliniques.
Ces tests devront être à la fois sensibles et spécifiques, performants et robustes et fournir des valeurs prédictives élevées, adaptées à leur utilisation et permettant leur intégration dans la chaîne de décision médicale.
Innovation thérapeutique
L’innovation thérapeutique dépend de plusieurs challenges. Celui de proposer un arsenal de nouvelles molécules thérapeutiques efficaces et celui que ces molécules puissent « entrer » en essais cliniques avec des soutiens financiers ad hoc. En résumé, il conviendra de maintenir une recherche interdisciplinaire en amont très active, afin d’accélérer les recherches précliniques. Deuxièmement, les contraintes liées au développement des antibiotiques et les spécificités de ce marché devront être intégrées dans les choix stratégiques d’investissement, afin d’assurer le financement des essais cliniques. Des accords de co-développement public-privé inspirés des programmes européens de type IMI (Innovative Medicine Initiative) devront être trouvés. À noter que les recherches galéniques, visant à fournir la formulation optimale pour la voie d’administration la mieux adaptée à l’organe cible, peuvent permettre de repositionner des antibiotiques devenus inefficaces, et devront donc être soutenues. Il sera aussi important de soutenir les recherches PK/PD visant à optimiser la posologie des antibiotiques administrés seuls et a fortiori en combinaison, afin d’en améliorer le rapport bénéfice/risque mais aussi de limiter l’émergence et le développement des résistances. Cette innovation thérapeutique est en lien très étroit avec les priorités de l’axe 4, qui s’oriente plus sur la recherche appliquée. Ainsi, l’utilisation rationnelle et optimisée de nouveaux antibiotiques issus de la découverte de nouvelles cibles médicamenteuses (axe 1) apparaît comme l’une des principales stratégies thérapeutiques pour contrer l’antibiorésistance (axe 4).
Priorités de recherche
En données massives et intelligence artificielle
- Données hospitalières
Les données hospitalières sont très détaillées mais historiquement peu structurées. La Haute Autorité de Santé (HAS) a développé des indicateurs nationaux quantitatifs concernant les infections associées aux soins (IAS), mais ces indicateurs sont difficiles à obtenir et pour la plupart nécessitent une analyse lourde des dossiers alors que leur calcul pourrait être automatisé. Il faut pour cela disposer d’un dossier patient informatisé comportant à la fois les données cliniques, biologiques et thérapeutiques, et de plus en plus d’hôpitaux suivent cette voie par la mise en place d’entrepôts de données. Cependant un important travail d’intégration des données doit être réalisé pour leur exploitation à grande échelle. Ceci permet d’obtenir une connaissance fine de l’utilisation réelle des antibiotiques, du contexte clinique, éventuellement des souches responsables et de leur susceptibilité aux antibiotiques, de l’évolution des traitements, de la mise en place d’outils de contrôle du bon usage des médicaments, et enfin le développement d’indicateurs automatisés.
- Données communautaires
En médecine de ville, la variété des logiciels métiers et la dissémination des informations auprès de chaque cabinet médical, ou laboratoire d’analyses est un frein pour obtenir les mêmes connaissances.
- Données SNDS et Health Data Hub
Les données de remboursement des actes en ville et à l’hôpital, et de diagnostics hospitaliers, sont recueillies de façon exhaustive et chaînée au sein du SNDS. Ces informations, de par leur couverture et leur volumétrie, représentent une source de données sans égal en Europe. Toutefois, produites à des fins administratives, elles restent incomplètes (pas d’indication en ville, pas de données pharmaceutiques à l’hôpital) et dépendante de l’évolution des règles administratives et des stratégies de codage. La mise en place de l’infrastructure nationale du Health Data Hub, et l’évolution réglementaire qui l’accompagne, devrait permettre de chaîner toutes les données produites dans le cadre de soins remboursés par l’assurance maladie. De nombreux travaux pourront ainsi s’appuyer sur ce nouveau cadre pour obtenir le contexte de la prescription, les traitements administrés, le germe en cause et ses résistances possibles.
- Données animales
Dans le secteur animal, les dispositions législatives et réglementaires adoptées dans le cadre du premier plan Ecoantibio et de la loi d’avenir du 13 octobre 2014 pour l’alimentation, l’agriculture et la forêt, prévoient pour de nombreux acteurs de la chaîne du médicament vétérinaire et de l’aliment médicamenteux, une obligation de déclaration des antibiotiques cédés. Comme dans les autres secteurs de soins, cette centralisation se heurte aux difficultés opérationnelles rencontrées classiquement aux différentes étapes de mise en place d’un tel dispositif (collecte, harmonisation, transmission, stockage, accessibilité des données). Leur exploitation, tant pour le secteur animal lui-même que dans une perspective intersectorielle, est un enjeu-clé de maîtrise de la prescription vétérinaire des antibiotiques. Cette exploitation doit également permettre une mise en regard avec les données de surveillance de l’antibiorésistance collectées dans le secteur animal, mais également dans le secteur médical et dans l’environnement, afin de mieux identifier les voies majeures de sélection, y compris croisée, de l’antibiorésistance. À ce titre, le réseau français RESAPATH, unique en Europe, en collectant les données d’antibiorésistance a accès à des informations utiles à la compréhension des mécanismes de sélection et de circulation des bactéries multi-résistantes (données géographiques, zootechniques, moléculaires et génomiques). Cependant, l’exhaustivité et l’inter-opérabilité avec les données analogues des autres secteurs sont perfectibles. Ces constats valent également pour les données collectées au niveau européen par les États membres (dont la France) dans le cadre des plans de surveillance réglementaires de l’antibiorésistance à l’abattoir et dans certains aliments d’origine animale. Au final, la contribution du secteur vétérinaire à la mise en place d’une base de données globale est un enjeu majeur qui croise également avec ceux identifiés dans l’axe 1.
- Données issues de l’environnement
Les réseaux de recherche et de surveillance de l’environnement recueillent actuellement des données permettant de suivre la circulation de BMR, de supports génétiques et de vecteurs de résistance au sein de multiples composantes de l’environnement allant des effluents d’élevage aux eaux usées en passant par la faune sauvage et les sols. Ces informations sont ainsi à la fois de différentes natures (souches bactériennes, gènes, supports génétiques, etc.) et issues de différentes sources (eau, sol, faune sauvage, etc.) qui doivent être précisément décrites afin que les données soient exploitables. Une partie de ces données sont déjà déposées dans des bases libres d’accès telles que GenBank ou ARBD (Antibiotic Resistance Genes Database). Cependant la mise en place d’une base les rassemblant, homogénéisant la façon de les caractériser et permettant de les mettre en lien de façon opérationnelle avec les données issues des élevages, des hôpitaux et de la médecine de ville est nécessaire à la progression de notre compréhension des voies de transmission des antibiorésistances entre les différents compartiments. La mise en place d’une telle base de données et des moyens de l’exploiter est à relier à l’action 4 de l’axe 1.
- Interactions avec les autres axes
Celles-ci peuvent être multiples et le déploiement de logiciels pour l’analyse de données massives doit fournir de la puissance à la recherche fondamentale. Notamment, les priorités des axes 1 et 3 demandent l’intégration d’approches innovantes pour la compréhension fine des processus mis en jeu : approches « omiques » (génomique, métagénomique, transcriptomique, protéomique, métaprotéomique et métabolomique), les études en « single cell », les nouvelles méthodes d’imagerie et des approches mathématiques et informatiques, notamment d’apprentissage. Des outils mathématiques doivent être utilisés pour combiner les données de surveillance et les connaissances mécanistiques afin de modéliser les processus intervenant dans la sélection et la dissémination des souches résistantes aux antibiotiques chez l’humain et l’animal ainsi que dans l’environnement. L’ensemble de ces modèles permettra d’évaluer, et prédire, le niveau de risque d’acquisition et de transmission de la résistance aux antibiotiques, associé à des politiques d’utilisation des antibiotiques, au niveau local ou national, des mesures de prévention liées aux soins, des procédures en élevage et de traitement des eaux. Dans le cadre de l’axe 2, l’analyse épidémiologique à des fins d’inférence causale, pour mettre en évidence l’effet d’une intervention opulationnelle ou d’une pseudo-intervention à partir de données observationnelles, fait appel à des modèles d’ajustement de données en grande dimension issus des développements les plus récents de l’intelligence artificielle. Ces méthodes visent à tirer le meilleur parti de la grande volumétrie et la complexité des données. Elles doivent être utilisées avec le souci de la transparence et de la reproductibilité de la méthode retenue.
En tests diagnostiques
- Pour la prise en charge thérapeutique
Pour que celle-ci soit la plus adaptée et la plus précoce possible, il est nécessaire de disposer de tests rapides (≤2-4h à partir du prélèvement), peu chers, simples d’emploi et à mettre en oeuvre, permettant de détecter et d’identifier le plus rapidement possible le type d’infections, l’espèce bactérienne et les résistances en jeu. Ces tests devront pouvoir être effectués directement à partir des échantillons environnementaux ou cliniques (sang, urine, écouvillons rectaux, lait…) dans un contexte « Une seule santé ».
- Pour les études épidémiologiques (en lien avec l’axe 1)
Les tests doivent être très spécifiques et précis (approches -omiques globales et ciblées : métabolomique, protéomique, permettant entre autres d’identifier précisément des variants/mutants protéiques, des métabolites et produits de réaction spécifiques de phénomènes de résistance), pouvant être mis en oeuvre à grande échelle mais ne nécessitant pas d’être rapides ou très sensibles (l’analyse peut être réalisée à partir de colonies isolées).
- Pour la découverte et la validation de nouveaux biomarqueurs
L’identification de nouveaux biomarqueurs d’infection et de mécanismes de résistances permettra le développement de nouveaux tests diagnostiques plus performants et prédictifs.
Pour ces tests, des développements technologiques sont nécessaires à chacune des trois étapes suivantes : 1) Pré-analytique, du prélèvement de l’échantillon à sa préparation pour l’analyse, 2) Analytique, de la préparation de l’échantillon à la réalisation du test.
Les recherches devront porter sur la rapidité/simplicité de préparation de l’échantillon, pour une variété et complexité de matrices importantes (biologiques – humaines ou vétérinaires – : sang, fèces, urine, expectorats, lait… ou environnementales/alimentaires), et pour des quantités de bactéries présentes dans l’échantillon très variables (de quelques bactéries à 106 à 108 bactéries/ml ou /g) et, 3) Post-analytique, de l’obtention du résultat à la communication et l’interprétation des résultats. Ceux-ci doivent être fiables, objectifs, disponibles sur place ou transmis (diagnostic connecté) pour une analyse éventuellement déportée, au plus près du prescripteur et fournissant éventuellement une recommandation thérapeutique non ambigüe et la plus personnalisée possible. Des algorithmes intégrant les résultats des tests dans l’ensemble des données disponibles ou potentiellement accessibles pour les patients, individuellement ou collectivement pourraient profondément transformer la pratique de l’antibiothérapie et constituer une composante majeure d’un Steward-ship renouvelé.
Pour tous les types de tests deux grandes catégories technologiques devront être explorées sans a priori :
- les tests moléculaires : basés sur la détection et l’identification de gènes de résistances aux antibiotiques, par des approches ciblées (PCR) ou non ciblées (séquençage haut-débit). Les grands enjeux de ces tests résident dans la diminution de leurs coûts, leur adaptation à une utilisation la plus « terrain » possible, et pour les approches non ciblées un rendu de résultats rapide ;
- les tests phénotypiques : basés sur la détection directe ou indirecte des marqueurs d’infection ou de résistance (biomarqueurs produits par l’hôte ou biomarqueurs produits par les pathogènes eux-mêmes), leur activité ou leurs conséquences (produits d’hydrolyse des antibiotiques, analyse des modifications de la cible…).
Toutes ces approches étant complémentaires, il convient de développer des approches intégrées permettant de combiner différentes techniques afin d’obtenir différents niveaux d’informations délivrées. Les enjeux résident entre autres dans l’augmentation de la sensibilité de ces tests, leur simplification de mise en oeuvre, la diminution de leur durée d’exécution et de leurs coûts.
En innovation thérapeutique
- Chercher et développer de nouveaux principes actifs L’identification des principes actifs agissant par des mécanismes inexploités constitue la pierre angulaire de la mise au point d’antibiotiques nouveaux au long terme. Plusieurs molécules, incluant même un anticorps monoclonal, sont en phases de développement plus ou moins avancées. Les facteurs clés du succès dans cette quête vers de nouveaux candidats médicamenteux sont au nombre de 4 :
- comprendre des mécanismes de résistance et d’adaptation des bactéries à leur environnement (cellule ou tissu hôte) compris dans l’axe 1 ;
- revisiter les chimiothèques (telle que la chimiothèque nationale incluant de nombreuses substances naturelles) et les collections de microorganismes éventuellement non-cultivables (permettant d’explorer des espaces chimiques nouveaux et pouvant être criblées) par une double approche associant modèle phénotypique et modèles « pathway-specific » ;
- intégrer des équipes de chimie médicinale, de biologie structurale, de modélisation moléculaire, et des équipes de biologistes (des appels d’offres du types « Chimie pour la médecine » de la FRM sont exemplaires) ;
- initier de façon précoce des études pharmacocinétiques et pharmacodynamiques (PK-PD) in vitro et sur des modèles animaux afin de sélectionner les meilleures modalités d’administration (dose de charge et dose d’entretien, intervalle entre les doses, durée totale du traitement…) pour les essais cliniques (réalisés par exemple dans l’axe 4).
- Revisiter des principes actifs bénéficiant d’une AMM
Il peut s’agir d’une nouvelle indication, d’une nouvelle voie d’administration et/ou formulation, ou encore de nouvelles combinaisons. Ce type de recherche concernant souvent des molécules n’étant plus protégées par des brevets est principalement conduit par des équipes académiques, parfois en lien avec des start-up. Plusieurs appels d’offres tels que « Old drugs for new bugs » ont ainsi été lancés ces dernières années pour revisiter de vieilles molécules abandonnées du fait de leur toxicité comme par exemple la colistine, à l’aide des concepts et technologies modernes de PK/PD. Des projets JPIAMR visent à rechercher des synergies en combinant plusieurs antibiotiques entre eux ou un antibiotique avec une molécule non antibiotique comme les dérivés terpéniques d’origine naturelle. Le développement de boosters de l’éthionamide dans les thérapies anti-tuberculeuses illustre aussi la possibilité qui existe de trouver des solutions élégantes combinant anciennes et nouvelles entités chimiques afin de contourner la résistance des bactéries aux antibiotiques. Et une nouvelle étape de ce projet qui associe deux équipes académiques, une SME et une big pharma, pourra être franchie dans le cadre d’IMI. Ceci montre que de telles approches ne doivent pas être sous-estimées. - Améliorer le ciblage des principes actifs
L’administration d’antibiotiques directement au site infectieux constitue parfois la seule possibilité d’obtenir des concentrations actives ou d’augmenter le rapport bénéfice/risque en optimisant le rapport entre concentrations locales et systémiques. Ainsi l’UE a financé le projet PneumoNP afin de développer des nanoparticules contenant des peptides antibactériens pour le traitement des infections bactériennes à Gram négatif. Le traitement des infections ostéo-articulaires ou celui des infections pulmonaires à P. aeruginosa productrices de biofilms, constituent d’autres exemples pour lesquels la principale difficulté consiste à optimiser la diffusion de l’antibiotique au niveau de sa cible. Le développement de formulations galéniques adaptées et innovantes est alors sans doute plus important que la recherche de nouvelles molécules. Mais la vectorisation des antibiotiques ne se restreint pas au ciblage tissulaire. Le manque d’efficacité d’un antibiotique peut résulter d’une résistance, d’une mauvaise diffusion au site infectieux, ou d’une faible pénétration et rétention cellulaire lorsque les bactéries sont inaccessibles du fait de leur localisation intracellulaire (par exemple dans les macrophages). L’optimisation galénique peut alors viser à améliorer la diffusion intracellulaire des antibiotiques par des approches utilisant des nanotechnologies ou/et grâce à une meilleure compréhension de systèmes de transport comme par exemple des sidérophores pour des couplages innovants. Le ciblage peut aussi viser la délivrance d’antigènes lors d’approches vaccinales/préventives innovantes.
Objectifs et plan d’actions
Objectif 1 • Intégrer l’ensemble des bases de données de santé et la m-santé (mobile santé) via le développement d’outils spécifiques et de l’IA en médecine hospitalière et de ville ainsi qu’en médécine vétérinaire et les collectes de données de l’environnement en s’appuyant sur le Health Data Hub (quantité des données, qualité de leur annotation, chaînage).
Action 22 : Nous développerons des analyses/partage des données associées sous un format standardisé pour des études épidémiologiques globales. Nous intégrerons dans ces développements les données d’autres sources (environnementales, agronomiques, vétérinaires…).
Action 23 : Nous développerons la m-santé (pour services de santé disponibles en permanence via un appareil mobile) appliquée à l’antibiorésistance : outils connectés, logiciel d’aide à la décision/prescription, bases de données communes, ouvertes et standardisées.
Action 24 : Nous appuierons et proposerons d’établir un lien avec le Health Data Hub et étudierons le développement d’un hub local incluant des données animales et environnementales.
Indicateurs
- Nombre de sources de données utilisables sous une gouvernance commune.
- Nombre d’utilisateurs utilisant un service de santé mobile.
- Nombre d’articles impliquant ces sources de données et passant par le Health Data Hub.
- Rapport d’analyse sur la pertinence
Objectif 2 • Développer des outils d’analyse, de partage et d’exploitation de données pour réaliser des études épidémiologiques pour l’identification des résistances aux antibiotiques, leur évolution et leur propagation en lien avec l’axe 1 (biomarqueurs, approches « -omiques », partage de données, monitoring), et des organisations des soins et interventions les plus efficientes pour réduire l’antibiorésistance.
L’objectif recherché est de développer des approches intégrées ciblées et globales dans le domaine de la résistance aux antibiotiques pour identifier et valider de nouveaux biomarqueurs bactériens de résistance de différentes origines (ADN/ARN/exosomes/protéines/métabolites…) et des interventions, organisation des soins, ou combinaisons de traitements existants qui s’avèreraient efficientes.
Action 25 : Nous veillerons à faire appel aux infrastructures et référentiels existants, dans un cadre respectant la sécurité et la confidentialité des données personnelles. L’Institut Français de Bioinformatique (IFB) sera notamment sollicité pour envisager une collaboration dans ce domaine.
Action 26 : Nous mettrons en place une gouvernance de ces données, en veillant à leur adéquation avec les règles internationales et en accompagnant leur mise en place, en particulier dans les pays ne bénéficiant pas d’infrastructures.
Indicateurs
- Identification et utilisation d’infrastructures d’hébergement et d’exploitation de données massives incluant des biomarqueurs et données omiques dans un cadre sécurisé.
Objectif 3 • Permettre de différencier rapidement une infection bactérienne (gram+/gram-) d’une infection fongique, virale ou parasitaire, et identifier le microorganisme pathogène impliqué, afin d’éviter l’administration d’antibiotiques non justifiée.
Action 27 : Nous identifierons et validerons des biomarqueurs directs ou indirects capables de différencier une infection virale d’une infection bactérienne par des approches ciblées ou non ciblées et nous développerons des tests sensibles, spécifiques, éventuellement multiparamétriques permettant une identification rapide et bas coût « point of care » sans étape préalable de culture, directement sur échantillons cliniques vétérinaires et humains (lait, sang, urine, fèces, expectorations, salive). Nous favoriserons la mise au point d’outils diagnostiques permettant d’évaluer et de mieux caractériser « en temps réel » l’état immunitaire des patients à haut risque d’infection (sujets âgés, réanimation, chirurgie lourde…).
Indicateurs
- Mise à disposition de tests terrain rapides, sensibles, simples et à faible coût pour différencier une infection bactérienne d’autres infections directement dans des échantillons biologiques et environnementaux.
Objectif 4 • Développer des outils de détection précoce et individualisée des infections bactériennes dans les élevages afin de cibler les interventions, réduire le nombre d’animaux traités et la consommation d’antibiotiques.
Action 28 : Nous favoriserons le développement et l’implémentation de méthodes issues de l’intelligence artificielle pour la détection précoce des infections bactériennes dans les troupeaux à partir de l’analyse de signaux issus de capteurs électroniques embarqués ou de vidéos. Cette étape de détection à l’échelle individuelle est un prérequis à l’élaboration de stratégies d’interventions (diagnostiques, thérapeutiques …) plus ciblées qui se substituent aux traitements de groupes entiers.
Indicateurs
- Mise à disposition d’outils (algorithmes) permettant de détecter précocement les maladies et d’établir des stratégies d’interventions qui limitent l’utilisation des antibiotiques.
Objectif 5 • Développer des tests de première intention plus rapides, sensibles et moins chers « Point of Need, Point of Care », afin d’identifier la souche bactérienne et les potentiels mécanismes de résistance, de manière à administrer mieux et plus vite le bon traitement, et éviter la dissémination de la résistance.
Action 29 : Nous raccourcirons la durée et simplifierons au maximum le test de première intention d’identification de la résistance (du prélèvement au résultat), afin de s’affranchir des étapes de culture en développant des méthodes directement utilisables sur prélèvement biologique, à des coûts les plus faibles possibles dans un contexte « Une seule santé ».
Action 30 : Nous développerons des approches ciblées et non ciblées innovantes, performantes et complémentaires de type génotypique (séquençage de génome complet/métagénomique/métatranscriptomique, PCR) et/ou phénotypique (protéomique/métaprotéomique/métabolomique/immunologique/biochimique…) à bas coût pour des tests de confirmation, pour l’analyse de populations microbiennes dans le contexte « Une seule santé » (alimentation, environnement, clinique – conditions normales et pathologiques : microbiote, infections –, vétérinaire) ou à visée épidémiologique, et pour proposer de nouvelles cibles (biomarqueurs) pour le développement de nouveaux tests de première intention.
Action 31 : Nous augmenterons les performances des tests et leur capacité de multiplexage (détection de plusieurs types de biomarqueurs de résistance simultanément). Nous proposerons des méthodes innovantes pour différencier et quantifier les différents mécanismes de résistance aux antibiotiques d’isolats cliniques et leur éventuelle induction dans le contexte de l’hôte et de traitements thérapeutiques.
Action 32 : Nous développerons des tests de susceptibilité aux antibiotiques qui soient simples, rapides (moins de 4 heures), faible coût et si possible décentralisés.
Indicateurs
- Mise à disposition de tests terrain rapides, sensibles, simples et à faible coût pour identifier les pathogènes en cause, les mécanismes de résistance et la susceptibilité aux antibiotiques directement dans des échantillons biologiques et environnementaux.
- Identification et validation de nouveaux biomarqueurs d’infection et de résistances aux antibiotiques.
Objectif 6 • Développer des outils simples de décontamination et de contrôle de la décontamination de surface (surfaces inertes, outils interventionnels, mains, etc.).
Action 33 : Nous développerons de nouveaux désinfectants de surfaces en s’appuyant sur de nouvelles techniques et molécules (par exemple l’utilisation de bactériophages). En parallèle, nous encourageons la recherche sur de nouveaux désinfectants de dispositifs médicaux, telles que de nouvelles molécules détergentes-désinfectantes et de nouvelles techniques de stérilisation (à basse température). Nous encourageons le développement en techniques de quantification de la contamination bactérienne et l’identification de micro-organismes indicateurs de contamination. Ces développements se feront en tenant compte de leur innocuité pour l’environnement et paraissent indispensables pour lutter contre les infections liées au soin dans les établissements de santé (humaine et animale).
Objectif 7 • Accélérer la R&D de nouveaux antibiotiques via la chimie afin de renouveler l’arsenal médicamenteux.
Action 34 : Nous faciliterons le regroupement et la mise à disposition des chimiothèques commerciales et nationales sur un seul site internet permettant leur diffusion et leur accès à des coûts modérés. Et nous solliciterons les chimistes nationaux pour qu’ils rendent accessibles leurs chimiothèques privées selon des modalités à définir (aide à la mise en plaques, aide à l’achat, négociation des tarifs…). À l’image de ce qui est proposé par l’association Vaincre la mucoviscidose qui finance l’élevage et la distribution d’un modèle animal de la mucoviscidose (lignée de souris) pour faciliter le travail des chercheurs, nous mettrons en commun sur un site dédié (dans la limite des questions de propriété intellectuelle par exemple), l’ensemble des résultats de criblages des équipes de recherche pour éviter la répétition d’expériences inutiles et permettre une analyse plus fine de l’avancement des programmes.
Action 35 : Nous encouragerons les approches multidisciplinaires, regroupant des équipes de chimie médicinale, de biologie structurale, de modélisation moléculaire et de biologistes qui sont déjà impliqués dans les phases amont de la R&D pour la découverte de nouvelles molécules et la caractérisation de leur activité antimicrobienne.
Action 36 : Nous initierons précocement des études PK-PD in vitro et in vivo sur des modèles animaux. Nous établirons une cartographie des plateformes capables de réaliser des tests d’efficacité in vivo, en précisant les espèces et les modèles infectieux disponibles en fonction des niveaux de protection requis, mais aussi des spécificités (par exemple, les équipements permettant des nébulisations répétées d’antibiotiques chez le rongeur) ou du matériel d’imagerie (par exemple les appareils de mesures de bioluminescence). En lien avec l’axe 4.
Indicateurs
- Dépôts de brevets en lien avec la découverte de nouvelles substances à propriétés antibiotiques ou adjuvantes.
- Obtention de molécules candidates à des essais précliniques et cliniques de phase 1.
Objectif 8 • Optimiser l’efficacité et l’efficience des antibiotiques déjà commercialisés.
Action 37 : Nous revisiterons les antibiotiques déjà commercialisés, à l’instar de la colistine, afin de tester leur intérêt potentiel vis à vis de souches résistantes, en monothérapie et surtout en combinaisons, afin d’augmenter l’efficacité, limiter la toxicité et éviter la sélection de mutants résistants.
Action 38 : Nous développerons des approches PK/PD modernes inspirées de celles utilisées dans d’autres familles thérapeutiques, pour adapter la posologie des antibiotiques à marge thérapeutique étroite (en lien avec l’axe 4).
Action 39 : Nous développerons de nouvelles méthodologies afin d’optimiser l’usage des antibiotiques en combinaisons.
Action 40 : Nous choisirons la voie d’administration la plus adaptée et adapterons la formulation et/ou nous développerons des «prodrugs», pour mieux cibler le foyer infectieux.
Indicateurs
- Mise en place puis publications d’études de pharmacocinétique clinique d’antibiotiques déjà commercialisés, portant sur des indications ou des modalités d’administrations nouvelles en particulier dans le cadre de programmes hospitalier de recherche clinique (PHRC).
- Obtention de financements et réalisations d’essais cliniques dans le contexte « old drugs for new bugs ».
Axe 4 • Stratégies thérapeutiques et préventives innovantes
Contexte
Malgré le besoin de nouveaux antimicrobiens pour un usage clinique, seulement un faible nombre d’antibiotiques a été mis sur le marché au cours des 30 dernières années et de nombreuses firmes pharmaceutiques ont quitté le domaine. Cela est lié au fait que la découverte et le développement de nouveaux agents antibactériens sont difficiles et l’introduction de telles thérapeutiques soulève potentiellement d’importants problèmes de réglementation. Actuellement, des efforts sont déployés pour explorer de nouvelles voies de lutte contre la résistance aux antimicrobiens en dehors du paradigme des antibiotiques. À titre d’exemple, l’utilisation d’anticorps monoclonaux (mAbs) comme molécules antibactériennes est envisagée mais n’a pas été évaluée de manière approfondie. Parce qu’ils ne se lient pas aux mêmes cibles bactériennes que les antibiotiques, ils pourraient compléter les antibiotiques dans la gestion des infections difficiles à traiter. D’autres molécules innovantes (peptides, bactériophages, lysines…) pourraient contribuer à surpasser les résistances actuelles aux antibiotiques en raison de mécanismes d’actions différents, et aussi offrir des opportunités thérapeutiques dans la lutte contre les infections bactériennes graves. Ceci doit aussi être contextualisé avec l’augmentation très notable de l’immunodéficience ou tout au moins de l’immuno-altération, non seulement liée à l’augmentation de l’espérance de vie mais aussi aux progrès scientifiques qui permettent à des patients, atteints autrefois de maladies réputées mortelles, de survivre. Ceci renforce la pertinence des thérapeutiques ciblant le déséquilibre des défenses de l’hôte, aussi bien sur le volet du patient (immunothérapie) que sur celui du pathogène (anti-virulence).
Un défi général dans le processus de mise au point de nouveaux médicaments est le manque de mécanismes par lesquels les chercheurs, les développeurs de médicaments et les cliniciens peuvent partager des données et des expériences du développement de candidats médicaments. Cela conduit à une duplication des efforts et finalement à des inefficacités dans le processus.
Enjeux
Tout citoyen est confronté de nombreuses fois dans sa vie à des problématiques infectieuses et a été, et sera, exposé à une thérapie antimicrobienne. Il sera donc tôt ou tard directement ou indirectement confronté aux risques de résistance au traitement. Le « sortir du tout antibiotique » est donc indéniablement un problème de santé publique et l’affaire de tous. Aussi, même si de nombreux opérateurs agissent actuellement dans le domaine de l’innovation thérapeutique en infectiologie bactérienne au niveau du territoire national, la poursuite du développement d’un tissu scientifico-économique dans ce domaine qui serait interconnecté avec les acteurs de l’investigation pré-clinique et clinique est indispensable et doit être accompagnée. Même si plusieurs SME françaises opèrent dans le domaine des anti-infectieux et que l’Europe reste très performante dans le domaine des réelles innovations thérapeutiques en infectiologie bactérienne, il faut constater que les biotechs américaines attirent une très grande partie des budgets de recherche du domaine. Il est donc primordial d’aider les équipes françaises – et européennes – à se maintenir dans la compétition mondiale de la lutte contre l’antibiorésistance.
C’est d’ailleurs forte de ce constat que la BEAM alliance a été créée pour fédérer la dynamique au niveau européen. Même si cette création et la prise de conscience du nécessaire soutien à ces entreprises ont permis à plusieurs d’entre elles d’obtenir de réels moyens pour innover, le paysage reste hétérogène avec des innovations qui mériteraient d’être plus soutenues pour pouvoir prétendre aller jusqu’au patient.
L’accompagnement de nouvelles stratégies conduisant à de réelles innovations thérapeutiques doit pouvoir connecter en pratique des mondes relativement différents avec une approche « Une seule santé » et donc envisager dès l’origine la dimension santé humaine, santé animale et environnement.
En santé humaine, la plus grande partie de la consommation antibiotique est réalisée en médecine de ville. Aussi, l’innovation thérapeutique ne saurait être réservée à la médecine hospitalière, même si c’est là que le problème de l’antibiorésistance est le plus prégnant. Un des enjeux réside dans la capacité à embarquer les acteurs des soins primaires dans une telle dynamique.
Sur le volet animal, aborder la problématique de l’antibiorésistance dans sa dimension « Une seule santé » revient à considérer en priorité les risques pour l’humain de l’usage des antibiotiques chez les animaux, en lien avec les interconnexions Humain-Animal-Environnement dans une dimension écologique globale, mais aussi les disparités économiques au niveau international. En raison de ce contexte, et compte-tenu des niveaux de consommations d’antibiotiques respectifs, les enjeux portent principalement sur les animaux d’élevage producteurs de denrées pour l’humain*, même si l’animal de compagnie ne doit pas être négligé.
Enfin, la problématique de l’antibiorésistance n’étant pas circonscrite à nos frontières, bien au contraire, il faut envisager dès l’origine des innovations la question de leur accessibilité pour les pays à faibles revenus et les populations les plus défavorisées.
*Composante du défi imposé à l’agriculture de demain : la globalisation des économies et des agricultures, les attentes croissantes des citoyens vis-à-vis de l’élevage, des impacts environnement et pour un moindre recours aux « intrants médicamenteux », exigent une évolution vers des systèmes d’élevage durables et soucieux du bien-être animal. La maîtrise des infections bactériennes s’inscrit dans cette d’évolution. Elle s’appuie sur des stratégies de gestion intégrée de la santé des animaux qui utilisent une palette très large d’outils, ciblant principalement la prévention des maladies, qui ne seront pas abordés dans ce document.
Priorités de recherche
Parmi les différentes innovations thérapeutiques et autres stratégies innovantes, certaines apparaissent plus à même de venir modifier les pratiques cliniques dans un avenir proche avec de véritables débouchés pour les patients, les animaux et pour lutter de manière plus générale contre l’antibiorésistance.
Médecine humaine
- L’immunothérapie représente indéniablement une des pistes les plus prometteuses, non seulement pour immuno-restaurer les patients afin de leur permettre de mieux se défendre contre les infections, à l’heure où de plus en plus de malades sont immuno-altérés, mais aussi pour apporter des stratégies thérapeutiques spécifiques. Dans ce domaine, les anticorps monoclonaux semblent proches de la mise sur le marché avec des approches à la fois préventives, curatives et protectrices. Au sein de cette aire thérapeutique, les premiers essais cliniques ont déjà été réalisés avec même des études de phase 3 en passe d’être montées pour ce qui concerne les molécules les plus prometteuses. Même si ces stratégies sont majoritairement portées par les industriels, les acteurs académiques français sont très fortement impliqués dans leur validation.
- Les peptides antimicrobiens, bien qu’étant étudiés depuis de nombreuses années, n’ont pour autant pas encore réussi à aller jusqu’à une utilisation clinique faute de résultats positifs lors des essais thérapeutiques en phase précoce. Pourtant, cette classe thérapeutique présente de nombreux avantages et pourrait être positionnée comme adjuvant à l’antibiothérapie plutôt qu’en substitution stricte. Ces peptides pourraient aussi être utilisés pour leurs propriétés antiseptiques et comme immuno-stimulants. En dépit des échecs de développement passés, ces composés mériteraient d’être soutenus et de nouveau testés dans des indications thérapeutiques plus ciblées. Dans ce domaine, qui reste encore en phase translationnelle, les acteurs académiques y jouent un rôle prépondérant.
- Même si la lutte contre l’antibiorésistance passe par une réduction drastique de leur utilisation, les antibiotiques doivent garder leur place dans notre pharmacopée et leurs conditions d’usage mériteraient d’être revisitées. Dans ce domaine une des thématiques prioritaires est aussi d’évaluer l’impact des antibiotiques/alternatives sur les microbiotes commensaux (et en particulier digestif) en termes d’émergence et de diffusion des résistances, à l’aide d’une méthodologie standardisée, pour permettre de classer les solutions thérapeutiques par risque décroissant. Par ailleurs, en amont de la promotion de l’usage prudent/responsable/approprié des antibiotiques existants (ou antibiotic stewardship, cf. Axe 2), des recherches spécifiques devraient être conduites et soutenues afin de valider de nouveaux protocoles d’usage que ce soit en termes d’indications, de durées de traitement, ou d’associations d’antibiotiques dont des déclinaisons soient applicables à la fois dans les structures de soins et la médecine de ville. Les associations antibiotiques/non-antibiotiques, avec des agents « adjuvants » qui optimisent l’activité antibactérienne ou ciblent les mécanismes de résistances (à l’image des inhibiteurs de beta-lactamases) semblent également prometteuses. Les approches PK/PD appliquées en phase préclinique à l’analyse des données in vitro ou issues de modèles animaux (axe 3) permettront de définir les modalités d’administration qui seront évaluées dans un contexte clinique. De nouveaux critères d’évaluation doivent aussi être développés pour permettre de différencier les molécules correctement et non uniquement sur base infection-durée de traitement (ex. : impact sur la virulence, interaction avec le système immunitaire, impact sur la flore…). Une des particularités des antibiotiques par comparaison à d’autres classes thérapeutiques est d’avoir des cibles partagées par différentes espèces bactériennes, ce qui définit leur spectre d’activité. Pourtant des molécules à spectre « très étroit », voire des antibiotiques « monopathogènes » qui commencent à être testés en phase clinique, pourraient contribuer à résoudre une partie des problématiques de résistance. Dans le chapitre antibiotique, il convient de positionner l’identification de nouvelles cibles permettant « d’attaquer » différemment les bactéries, avec de nouvelles molécules ou par repositionnement (drug repurposing) de médicaments actuels.
- Les bactériophages sont utilisés depuis plusieurs décennies dans certains pays et plus particulièrement dans les pays de l’ex Union soviétique (Ukraine, Géorgie) sans pour autant de preuves irréfutables de leur efficacité et de leur innocuité. Pourtant, cette approche qui repose sur les propriétés de certains virus pourrait venir compléter l’arsenal thérapeutique contre les bactéries et plus particulièrement dans des pathologies extrêmement difficiles à traiter, ou pour lesquelles certains patients se trouvent dans de véritables impasses thérapeutiques ou dans lesquelles les choix thérapeutiques sont limités. Les principales pathologies concernées sont les infections pulmonaires et les infections ostéo-articulaires, en administration locale. À souligner que la régulation européenne sur ce type de produit n’est pas forcément en harmonie avec celle d’autres pays développés. En France, les bactériophages sont utilisables à titre compassionnel comme préparation magistrale, sous la responsabilité d’un pharmacien, et sous la supervision de l’ANSM. Le principal frein à l’utilisation des bactériophages et à leur évaluation concerne la qualité du produit utilisé. En effet la production de bactériophages nécessite d’utiliser des bactéries en culture et la purification du produit final, c’est-à-dire l’élimination des produits bactériens et notamment des exotoxines et endotoxines, nécessite un processus spécifique. Les bactériophages non génétiquement modifiés ne semblent pas brevetables (produit naturel). Les lysines de bactériophages sont par ailleurs des protéines produites lors de la réplication des bactériophages, et elles sont des pistes thérapeutiques intéressantes, car elles ont un effet bactéricide qui leur est propre. Aussi, la recherche sur les bactériophages et les lysines de bactériophage doit être encouragée et soutenue. Par-delà l’utilisation compassionnelle, la recherche clinique occidentale dans le domaine des bactériophages se limite actuellement à quelques essais en phase précoce portés par un nombre très faible d’industriels, la complexité et surtout les problématiques réglementaires freinant leur développement par les académiques seuls.
- Le microbiote qui héberge en son sein des milliards de bactéries joue un rôle central dans l’homéostasie bactérienne, la résistance/sensibilité aux maladies, et aussi dans l’interconnexion Humain-Animal-Environnement via son statut de principal réservoir pour la dissémination des résistances bactériennes aux antibiotiques. Les stratégies de « manipulation » du microbiote par les probiotiques, la transplantation fécale ou la décolonisation sélective semblent très prometteuses dans ce contexte, et un effort de recherche tout particulier doit être fait dans ce segment en ayant pleinement conscience que la complexité de ce contexte le rend probablement plus difficile d’approche que d’autres. Ceci imposera d’impliquer de très nombreuses compétences, ce d’autant plus que cette problématique probiotique/microbiote se trouve à la « conjonction » des domaines santé humaine, santé animale, environnement et alimentation. Au sein de cette vaste thématique, la problématique de l’impact des vaccinations sur le microbiote est également à considérer. Le microbiote fécal utilisé à visée curative à l’égard de maladies humaines est considéré comme médicament, conformément à l’article L. 5111-1 du Code de la Santé publique. En l’absence d’autorisation de mise sur le marché, le microbiote fécal (comme les bactériophages) peut être utilisé dans le cadre législatif et réglementaire applicable aux préparations magistrales et hospitalières (article L. 5121-1 du Code de la Santé publique). Les préparations magistrales sont préparées extemporanément au vu de la prescription destinée à un malade déterminé. Elles doivent être réalisées dans le respect des Bonnes Pratiques de Préparation, qui prévoient notamment les modalités de suivi permettant d’assurer la traçabilité des médicaments, sous la responsabilité d’un pharmacien. Concernant le microbiote fécal, une coprothèque des préparations doit être réalisée, les échantillons devant être conservés durant au minimum 2 ans à -80 ° C. Dans le domaine du microbiote, la recherche est d’ores et déjà en phase clinique, pilotée à la fois par les industriels mais aussi des acteurs académiques français avec de nombreux projets allant du très amont et translationnel jusqu’aux phases plus tardives.
- Même si la vaccination ne saurait être considérée comme une véritable innovation thérapeutique et que sa généralisation à toutes les espèces de bactéries pathogènes se heurte au problème de l’identification de la cible, elle doit rester un des outils centraux de la lutte contre l’antibiorésistance. Plus que la mise au point de nouveaux vaccins qui est extrêmement complexe et reste le plus souvent l’apanage des grands groupes industriels, il convient de s’intéresser plus spécifiquement à l’influence de la vaccination antivirale sur les consommations antibiotiques et donc indirectement sur l’antibiorésistance.
- Aux côtés de certaines molécules/stratégies innovantes proches d’un applicatif clinique, d’autres approches plus expérimentales avec un potentiel de réponse à diverses parties du cycle infectieux (prévention, traitement, protection) mais aussi plus à distance d’une utilisation clinique méritent d’être accompagnées. À ce titre, les huiles essentielles présentent pour certaines d’entre elles des propriétés anti-infectieuses tout à fait intéressantes. D’autres molécules ciblant les facteurs de virulence, le quorum sensing ou les biofilms doivent être plus développées et testées pour juger de leur intérêt clinique. Il en est de même pour les bactéries prédatrices (Bdellovibrio bacteriovorus). Enfin, d’autres produits naturels comme le miel et la propolis sont dotés de propriétés anti-infectieuses qui pourraient être plus explorées dans des situations cliniques précises.
Médecine vétérinaire
Au-delà de la similitude des mécanismes généraux d’infectiologie bactérienne chez l’Humain et l’animal, les caractéristiques spécifiques au secteur animal doivent être prises en compte pour tenter d’identifier les stratégies d’innovation les plus prometteuses. Par exemple :
- Au niveau du marché de la santé animale, avec un chiffre d’affaires très inférieur à celui de la santé humaine, l’absence d’assurance maladie, la très forte segmentation du marché par espèce animale ou filière de production.
- Les impacts négatifs des traitements sur les microbiotes commensaux, en particulier le microbiote digestif « plaque tournante » des risques pour l’humain (sélection, amplification et dissémination des résistances), pèsent plus lourd dans la balance « bénéfices sur risques » de l’antibiothérapie animale. Quand pertinent, les impacts sur le microbiote environnemental sera considéré.
- Les réglementations spécifiques aux médicaments destinés aux animaux producteurs de denrées pour l’humain, relatives à la sécurité du consommateur (dossier « résidus ») et à l’impact sur l’environnement (dossier « écotoxicologie »).
Les stratégies sur le volet préventif chez l’animal
- Vaccination/Immunothérapie/Anti-virulence
Dans le domaine de la vaccination, la recherche/développement portée par les grands groupes industriels est dynamique, au moins pour les marchés rentables tels que les carnivores domestiques et les grandes filières des animaux de production : bovins, porc, volailles². La recherche dans le domaine de l’immuno-stimulation est prometteuse (voir le volet curatif). Sur le volet strictement préventif des approches vaccinales, elle pourra déboucher sur la mise au point de nouveaux adjuvants immunologiques. - Probiotiques et manipulations du microbiote/transplantation fécale
Les différentes stratégies ciblant le microbiote des animaux, en lien avec ses différents rôles dans : (i) la résistance/résilience des animaux face aux maladies, avec le développement de probiotiques ou de certaines huiles essentielles, (ii) le portage et la dissémination des résistances bactériennes aux antibiotiques, par la transplantation fécale, ou la décolonisation sélective ciblant certains pathogènes zoonotiques (portage sain de Salmonella, Campylobacter…). Parallèlement, des interventions sur le microbiote sont envisagées en « adjuvant » d’une antibiothérapie en vue de prévenir « en temps réel » son impact négatif sur le microbiote (sélection, amplification et dissémination des résistances)³ : des stratégies qui ciblent les bactéries du microbiote, comme une décolonisation sélective au moyen de bactériophages, ou des stratégies qui ciblent les antibiotiques, par destruction ou capture. La protection du microbiote peut également être envisagée grâce au développement d’antibiotiques « éco-compatibles » dont les propriétés pharmacocinétiques et physico-chimiques préviendraient leur diffusion dans les segments distaux du tube digestif et assureraient ainsi la préservation des écosystèmes bactériens non cibles (microbiotes et environnement). Le développement de ces stratégies se heurte ici particulièrement à la problématique de leur coût et plus généralement de leur acceptabilité, car elles ne sont pas associées à un bénéfice immédiat pour l’animal et visible par l’éleveur.
² Ici apparaît la problématique des espèces/indications dites « mineures », pour lesquelles on constate une absence d’investissement des industriels à cause de la faible rentabilité du marché. Le développement des auto-vaccins pallie le manque de vaccins dans certaines filières.
³ En se limitant aux interventions sur l’animal : les interventions sur l’environnement immédiat de l’animal (gestion des litières et effluents) sont plutôt en connexion avec le champ de l’axe 1.
Les stratégies sur le volet curatif chez l’animal
Sur le volet curatif, il est nécessaire de distinguer le domaine des « solutions thérapeutiques », où l’on retrouve les priorités de recherche proposées pour l’humain, et celui des « stratégies d’intervention en élevage », spécifique du secteur animal.
- Domaine des solutions thérapeutiques
La recherche dans le domaine de l’immuno-stimulation est prometteuse, comme en témoigne la récente mise sur le marché d’un agoniste PRR (Pathogen Recognition Receptor) chez les bovins.
Les recherches centrées sur les antibiotiques doivent être soutenues, avec l’objectif d’une optimisation des usages qui conduise à une réduction significative des quantités utilisées. Cela passe par : (i) revisiter et optimiser les conditions d’utilisation de l’arsenal thérapeutique actuel (doses et rythmes d’administration, durées des traitements), (ii) explorer des solutions innovantes en termes d’associations d’antibiotiques ou d’associations antibiotiques/ non-antibiotiques, avec des agents « adjuvants » qui optimisent l’activité antibactérienne. À l’identique de la médecine humaine, les approches PK/PD appliquées à la modélisation de données cliniques et précliniques, issues par exemple de modèles in vitro innovants, fournissent le cadre de travail pertinent pour l’évaluation et l’optimisation des solutions testées.
Les bactériophages constituent également une piste de recherche qui mérite d’être explorée dans des applications vétérinaires. Compte-tenu de ses particularités et du contexte réglementaire du médicament vétérinaire, cette approche pourrait apporter des solutions pour certaines pathologies, soit seule soit plus vraisemblablement en complément/adjuvant d’une antibiothérapie. Les recherches sur des molécules non-antibiotiques mais ciblant des facteurs associés à la pathogénicité et/ou la moindre sensibilité aux traitements antibiotiques sont également pertinentes. Il s’agit d’approches distinctes, ciblant les facteurs de virulence, le quorum sensing ou les biofilms.
Domaine des stratégies interventions en élevage
La recherche dans ce domaine a pour objectif de réduire les quantités d’antibiotiques utilisées pour le traitement des infections bactériennes en élevage. Elle s’appuie sur le développement d’outils technologiques et méthodologiques de détection précoce et individualisée des infections bactériennes dans les élevages. L’implémentation de ces outils permettra de développer des stratégies d’interventions thérapeutiques plus ciblées et plus efficaces qui se substituent aux traitements de groupes entiers.
Ces stratégies peuvent avoir un lien fort avec l’Axe 3 (détection/diagnostic/individualisation), en particulier via le développement d’outils de diagnostic rapide et sur le lieu d’intervention (point-of-need).
Ce champ d’innovations multidisciplinaire fait appel aux spécialistes de l’électronique (capteurs, systèmes embarqués, puces RFID), de l’analyse d’images (vidéo), et de l’intelligence artificielle en mobilisant des compétences de mathématiques/statistiques appliquées à l’apprentissage automatique (machine learning).
Objectifs et plan d’actions
Ambition : « Mettre sur le marché/à disposition des prescripteurs des stratégies préventives et curatives innovantes qui diminuent la prévalence des résistances bactériennes (flores pathogènes et microbiotes commensaux) »
Objectif 1 • Mettre au point une méthodologie standardisée pour évaluer, au
cours du développement des stratégies curatives et préventives innovantes destinées
à l’humain ou aux animaux, leur impact sur l’émergence et la diffusion des
résistances bactériennes qui prenne en compte à la fois les bactéries pathogènes
et les microbiotes commensaux.
Action 41 : Nous créerons des groupes d’experts chargés de définir des critères de jugement fiables pour évaluer lors des essais cliniques l’impact des interventions thérapeutiques sur l’émergence des résistances bactériennes chez les bactéries pathogènes et au sein des microbiotes commensaux (ainsi qu’environnementaux quand la question est pertinente).
Action 42 : Nous accompagnerons le développement d’un réseau professionnalisé de recherche clinique national opérant dans le domaine de l’infectiologie bactérienne, intégrant l’ensemble de ses sensibilités, afin de répondre aux exigences de participation aux essais cliniques qui évaluent des nouvelles molécules anti-infectieuses bactériennes.
Action 43 : Nous favoriserons le rapprochement entre les acteurs de la recherche (en particulier clinique) et les agences réglementaires au niveau national et européen pour réfléchir à des méthodologies et des critères spécifiques pour les essais visant à évaluer des stratégies alternatives aux antibiotiques et plus généralement qui visent à diminuer l’antibiorésistance.
Indicateurs
- Création d’une méthodologie spécifique ANSM (ex. : fast-track designation ou break-through) pour la recherche clinique dans le domaine de l’infectiologie bactérienne.
- Existence d’un réseau de recherche clinique français opérant dans le domaine de l’infectiologie bactérienne.
Objectif 2 • Développer et mettre sur le marché des stratégies curatives et préventives
innovantes qui augmentent les défenses de l’hôte et favorisent leur action.
Action 44 : Nous favoriserons le rapprochement des communautés de l’infectiologie et de l’immunologie et encouragerons la réalisation de travaux de recherche en commun et ciblés sur l’interaction immunité/résistance par le lancement d’appels d’offres spécifiques.
Action 45 : Nous développerons des stratégies thérapeutiques d’immuno-restauration par la mise au point de nouvelles molécules permettant un retour à l’homéostasie immunologique en contexte d’agression (chimiothérapie, état de choc, polytraumatisme…). Pour les animaux d’élevage, des épisodes de stress se traduisent par des altérations de l’efficacité des réponses immunitaires, pour lesquels le développement d’immunostimulants représente une piste de recherche prometteuse. Cette stratégie pourrait également s’appliquer aux carnivores domestiques à l’instar des indications décrites pour la médecine humaine, sur des animaux infectés chroniques ou immuno-déficients et à haut risque d’infection bactérienne.
Action 46 : Nous encouragerons le développement de nouvelles stratégies vaccinales antibactériennes et antivirales qui permettront de réduire l’utilisation des antibiotiques, en particulier mais non uniquement lors des épisodes infectieux hivernaux. La vaccination occupe une place prépondérante parmi les stratégies préventives en médecine vétérinaire et en particulier pour les animaux vivant en collectivité où le poly-microbisme est permanent. De nouveaux vaccins devront être capables d’induire une réponse immunitaire forte dans un contexte d’animaux déjà infectés. Le développement de nouveaux adjuvants est une étape incontournable à l’obtention de vaccins plus performants.
Action 47 : Nous encouragerons la démonstration de l’efficacité de stratégies thérapeutiques non vaccinales se positionnant comme alternatives à l’usage prophylactique des antibiotiques en élevage. Les stratégies ciblant le microbiote des animaux en lien avec son(ses) rôle(s) dans la résistance/résilience des animaux face aux maladies, comme les probiotiques ou certaines huiles essentielles, devront être évaluées selon des méthodologies validées.
Indicateurs
- Mise sur le marché d’outils de type Point-Of-Care pour immuno-évaluation avant traitement antibiotique.
- Suivi des consommations antibiotiques en médecine de ville en parallèle des épisodes viraux hivernaux.
Objectif 3 • Développer et mettre sur le marché des stratégies curatives et préventives
innovantes, qui ciblent les bactéries.
Action 48 : Nous accompagnerons le développement d’anticorps monoclonaux ciblant les bactéries à fort potentiel de résistance (Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae et Acinetobacter baumanii) pour des applications préventives et curatives chez l’humain dans des indications où les besoins thérapeutiques ne sont pas couverts. L’exploration des anticorps monoclonaux chez l’animal sera encouragée, en ciblant les carnivores domestiques compte-tenu du contexte de marché.
Action 49 : Nous favoriserons l’émergence de projets de recherches visant à développer des stratégies curatives et préventives innovantes ciblant les facteurs de virulence et notamment les toxines bactériennes.
Action 50 : Nous encouragerons le développement chez l’humain et l’animal d’associations de thérapeutiques antibactériennes, incluant les antibiotiques (AB) et des solutions non antibiotiques (non-AB) du type bactériophages, peptides antimicrobiens, agents physiques… (liste non exhaustive). Ces solutions (AB-AB, AB/non-AB, non-AB) devront être évaluées sur leur efficacité, leur capacité à réduire la consommation des antibiotiques concernés, et in fine l’émergence des résistances bactériennes. Des actions de concertation avec les agences règlementaires concernées devront être engagées pour accélérer la mise à disposition des stratégies les plus performantes dans des situations critiques spécifiques (ATU…).
Action 51 : Nous encouragerons les travaux de recherche visant spécifiquement à réduire les durées des traitements antibiotiques et à réduire leur spectre dans des situations cliniques bien définies.
Indicateurs
- Évolution du nombre de candidats médicaments dans de nouvelles classes thérapeutiques et ciblant la bactérie.
- Nombre de projets soumis en réponse à des appels à projets émis dans le cadre de PHRC dans le domaine de l’infectiologie.
Objectif 4 • Développer des solutions innovantes ciblant le réservoir de gènes de
résistance que constitue le microbiote digestif en vue de prévenir ou corriger la
sélection/amplification des résistances bactériennes exercée par les traitements
antibiotiques.
Action 52 : Nous évaluerons le co-bénéfice de l’auto-transplantation fécale dans des situations à haut risque dysbiotique (chimiothérapie, nutrition parentérale prolongée, choc septique…) en encourageant les travaux de recherche et les essais thérapeutiques dans ce domaine. Ce co-bénéfice de l’auto-transplantation fécale s’exerce dans la restauration du microbiote sur deux « fonctions »: 1) le microbiote « facteur de santé », 2) le microbiote « réservoir de résistances ».
Action 53 : Nous favoriserons les innovations thérapeutiques non microbiennes positionnées comme « adjuvants » d’une antibiothérapie en vue de prévenir « en temps réel » les processus de sélection/amplification des résistances, ces stratégies pouvant cibler les bactéries du microbiote (ex. : décolonisation sélective au moyen de bactériophages…) ou les antibiotiques (ex. : destruction, capture). Chez les animaux, le développement d’antibiotiques « éco-compatibles », dont les propriétés pharmacocinétiques préviennent leur diffusion dans les segments distaux du tube digestif, s’inscrit dans cette approche. Chez les animaux d’élevage spécifiquement, les mêmes stratégies (transplantation fécale, décolonisation sélective…) peuvent cibler le portage sain de pathogènes zoonotiques (Salmonella, Campylobacter…).
Indicateurs
- Développement des programmes de transplantation de microbiote en santé animale et humaine.